
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексный подход к изучению физиологических основ различий функциональных состояний и стрессорной устойчивости в норме и патологии 1 страница
|
|
|
|
!
Зо
сердца и сосудов (Кассиль Т.Н., 1983; Сергеев П.В., Шимановский Н.Л., 1987;- Шуба М.Ф., Кочемасова Н.Г., 1988 и др.).
У части декомпенсированных больных с высокой устойчивостью к гиперкапнии и гипоксии наблюдаемые изменения показателей гемодинамики во время пробы Штанге указывали на появление прес-сорного барорефлекса и гемодинамического бета—адренергического эффекта. Во второй половине задержки дыхания у лиц этой группы были обнаружены гемодинамические проявления прессорного хемо-рефлекса в виде увеличения УПСС и САД.
При сравнительном ан&аизе изменений показателей гемодинамики и омега—потенциала у декомпенсированных больных с умеренной и высокой толерантностью к транзиторной гиперкапнии и гипоксии появилась реальная возможность конкретизации физиологической значимости омега—потенциала, как коррелята ареактив-ности механизмов нейрорефлекторной регуляции ССС и ДС. Сниженной реактивности механизмов нейрорефлекторной регуляции ССС и ДС соответствовали среднелатентные или длиннолатентные слабой интенсивности сдвиги ОП в сторону позитивации или монофазное позитивное колебание потенциала.
В таблице 5 в обобщенном виде представлены соотношения динамики омега—потенциала во время выполнения пробы Штанге с ге-модинамическими эквивалентами различий реактивности механизмов нейрорефлекторной регуляции ССС и ДС у здоровых и больных лиц с разной толерантностью к транзиторной гиперкапнии и гипоксии.
Таким образом, обобщение полученных результатов позволило нам дифференцировать четыре типа соотношений (паттернов) изменения показателей центральной гемодинамики, опосредуемых уровнем реактивности барорецепторов сосудов малого и большого кругов кровообращения у здоровых лиц и больных в компенсированном и декомпенсированном состояниях (Рис. 5).
Известно, «то барорецепторное поле ствола легочной артерии и ее бифуркации может быть источником как прессорных, так и де-прессорных рефлексов (Дворецкий Д.П., 1966; Lewin R. et al., 1961; Coleridge J, KiddC, 1963; Kan W., LedsomeJ., 1976). Как и в случае вазоконстрикции легочных артерий, при растяжении легочных вен возникают разнонаправленные сдвиги артериального давления в большом круге и частоты сердечных сокращений (Дворецкий Д.П., 1966;AlbrookS. etal., 1972; Wilson N., LedsomeJ., 1983).
Р.Лоога (1964, 1988), В.Д.Лебедева (1989), D.G. Mc Closkey (1988) в эксперименте на наркотизированных собаках доказали, что раздувание легких может сопровождаться, с одной стороны, рефлекторной прессорной реакцией на уровне макрогемодинамики из—за раздражения барорецепторов легочных сосудов и сино—аортальной области; с другой стороны, — рефлекторной депрессорной гемодина-
Таблица 5 Соотношение динамики омега-потенциала с гсмодинамическими проявлениями реактивности механизмов нейрорефлекторной регуляции ССС и ДС у здоровых и больных лиц с разной толерантностью к гиперкапнии и гипоксии
| Толерантность к гиперкапнии и гипоксии | Реактивность механизмов нейрорефлекторной регуляции ССС и ДС | Характер гемодинамических сдвигов, реактивности барорецепторов и периферических хеморецепторов | Изменения омега—потенциала |
| I. ЗДОРОВЫЕ ЛИЦА | |||
| Низкая | Ареактивность | Ареактивность барорецепторов сосудов легких | Отсутствие изменений |
| Умеренно снижена | Высокая | Рефлекс Бейнбриджа вследствие высокой реактивности и раздражения барорецепторов правых отделов сердца и легочных артерий | Коротколатентная (5—15 с) монофазная негативная волна (А-13—22 мВ, Т-0,5— 1,0 мин) |
| Высокая | Повышена | Рефлекс Парина—Швигка в сочетании с активацией бета—адренорецепторов сердца и сосудов и оптимальной реактивностью барорецеторов | Среднелатентная (15—25 с) монофазная позитивная волна (А-6—14 мВ, Т-1,0— 1,5 мин) |
| Чрезмерно высокая | Чрезмерно высокая | Парадоксально высокая реактивность барорецепторов легочных сосудов, парадоксально высокореактивный прессорный барорсфлекс, переходящий в низкореактивный хеморефлекс | Длиннолатентная (25—40 с) монофазная позитивная волна (А-15—28 мВ, Т-1,0— 2,5 мин) |
| II. КОМПЕНСИРОВАННЫЕ БОЛЬНЫЕ | |||
| Низкая | Повышена | Высокореактивный депрсссорный барорефлекс при чрезмерно высокой реактивности периферических хеморецепторов | Коротколатентная (5—15 с) монофазная негативная волна низкой амплитуды (А-5-9 мВ) |
| Умеренно снижена | Повышена | Высокореактивный рефлекс Парина—Швигка при высокой реактивности периферических хеморецепторов | Коротколатентная (10—20 с) монофазная позитивная волна (А-8— 13 мВ) |
| Высокая | Повышена | Высокореактивный рефлекс Парина—Швигка при высокой реактивности периферических хеморецепторов | Среднелатентная (15—30 с) монофазная позитивная волна (А-14—27 мВ, Т-1,0— 1,5 мин) или сходные по интенсивности скачкообразные сдвиги в сторону позитивации |
| Чрезмерно высокая | Низкая | Низкореактивный рефлекс Парина—Швигка, переходящий в прессорный хеморефлекс | Длиннолатентный (30—60 с) слабый по интенсивности скачкообразный сдвиг в сторону позитивации на 3—8 мВ |
| III. ДЕКОМПЕНСИРОВАННЫЕ БОЛЬНЫЕ | |||
| Низкая | Ареактивность | Медиаторно опосредованная ареактивность барорецепторов сосудов малого круга кровообращения | Отсутствие изменений |
| Умеренно снижена | Низкая | Депрессорный барорефлекс с механизмом централизации кровообращения | Среднелатентный скачкообразный сдвиг в сторону позитивации на 3—7 мВ |
| Высокая | Низкая | ПрессОрный барорефлекс в сочетании с бета— адренергическим эффектом и прессорным хе- морефлексом | Длиннолатеитное (25—40 с) монофазное позитивное колебание потенциала (А-7— 13мВ) |
| Умеренно снижена | Низкая | Медиаторно опосредованная ареактивность барорецепторов сосудов малого круга кровообращения в сочетании с эффектами гуморальной активации бета— адренорецепторов сердца и сосудов | Отсроченная (на 25—40 с) плавная пози-тивация на 3—5 мВ |
| Высокая |
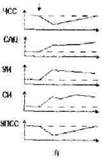

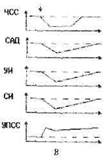

Рис. 5. Паттерны типовых соотношений изменения показателей центральной гемодинамики (А—Г) во время пробы Штанге, опосредуемые уровнем реактивности барорецепторов малого и большого кругов кровообращения у здоровых и больных лиц с разной толерантностью к гиперкапнии и гипоксии. Показатели пиковой латентно-сти и интенсивности см. при описании реактивности барорецепторов. По оси абсцисс — время (с), по оси ординат — исследованные гемодинамические показатели. Вертикальными стрелками обозначены начало и конец пробы Штанге.
мической реакцией вследствие адекватного раздражения рецепторов растяжения и спадения легких.
В наших исследованиях при ППА от 55 до 90 с и более обнаружены снижение ЧСС и повышение САД (Рис. 5А), что, согласно данным Д.П. Дворецкого (1966), Р.Лоога (1988), W.Kan, J.Ledsomc (1976), N.Wilson, J.Ledsome (1983), указывало на включение в системную гемодинамическую реакцию прессорного барорефлекса. В этих условиях одновременное увеличение УИ и уменьшение УПСС указывали на активацию бета—адренорецепторов сердца и сосудов (Сергеев П.В., Шимановский Н.Л., 1987; Авакян О.М., 1988; Шуба М.Ф., Кочемасова Н.Г., 1988).
Скачкообразное увеличение ЧСС и УПСС в сочетании со скачкообразным снижением САД, УИ и СИ при ППА от 10 до 55 с свидетельствовало о включении в системную гемодинамическую реакцию депрессорного барорефлекса с механизмом централизации кровообращения (Рис. 5Б).
Причиной возникновения депрессорного барорефлекса могло быть снижение насосной функции правых отделов сердца в условиях повышения внутригрудного давления и давления в малом кругу кровообращения при вдохе (Зильбер А.П., 1984; Данилов Л.Н., 1985). При этом, адаптивным гемодинамическим изменением была преходящая периферическая вазоконстрикция.
Рецепторное поле рефлексогенной зоны микроциркуляторного русла легких сформировано в основном окончаниями блуждающих нервов (Григорьева Т.А., 1954; Куприянов В.В., 1959). Характер ответа системной гемодинамики на раздражение этих барорецепто-ров полностью соответствует рефлексу Ларина—Швигка (Ткаченко Б.И., Дворецкий Д.П., 1984; Cheng E.Y. et al., 1989).
H.Schwiegk (1935) и независимо от него В.В.Парин (1939) экспериментально доказали, что повышение давления в сосудистом русле малого круга кровообращения приводит к рефлекторному падению системного артериального давления, брадикардии, вазодилятации в скелетных мышцах, увеличению кровенаполнения селезенки и вазодилятации в скелетных мышцах. В этих условиях величина рефлекторной активности зависела от состояния барорецепторов си-но—аортальной зоны.
Анализируя физиологическую сущность полученного рефлекса, авторы пришли к заключению, что в сосудах легких имеются баро-рецепторы, от которых в сосудодвигательный центр по блуждающим нервам поступают афферентные сигналы. Последний посылает эфферентные импульсы к сердцу и сосудам большого круга кровообращения, вызывая снижение притока крови в малый круг и тем самым предохраняет легкие от отека.
В наших наблюдениях при ППА от 35 до 90 с и более часто встречался рефлекс Парина—Швигка в виде одновременного снижения ЧСС, САД и УПСС (Рис. 5В).
Рефлекс Парина—Швигка мог появляться не только за счет транзиторной вазоплегии, но и вследствие преходящего снижения У И на фоне относительной периферической вазоконстрикции. Такого рода вариант регуляторной централизации кровообращения вследствие активации альфа—адренорецепторов сосудов, по всей видимости, был результатом снижения сократительной функции правого желудочка при повышении внутригрудного давления, что согласуется с экспериментальными данными Л-Н.Данилова (1985).
В реализации рефлекторных влияний с барорецепторов сосудов малого круга кровообращения существенное значение принадлежит изменениям гемодинамики в венозном отделе системной циркуляции. В 1915 году F.A. Bainbridge обратил внимание на одновременное увеличение частоты сердечных сокращений и артериального давления после внутривенного введения крови и кристаллоидного раствора у наркотизированных животных. Автор предположил, что рефлекс связан с растяжением правых отделов сердца, а афферентная импульсация передается по вагусу.
При исследовании гемодинамических эффектов гемотрансфузии у ненаркотизированных животных S.F.Vatner и D.H.Boettcher (1978) показали, что увеличение объема циркулирующей крови вызывает существенное повышение частоты сердечных сокращений, артериального давления и минутного выброса сердца. Напротив, при уменьшении объема циркулирующей крови авторы обнаружили снижение минутного объема кровообращения, артериального давления и увеличение частоты сердечных сокращений, т.е. доминирование барорецепторного рефлекса над рефлексом Бейнбриджа в системном гемодинамическом ответе.
Мы регистрировали рефлекс Бейнбриджа, представленный одновременным увеличением ЧСС, САД, СИ и УПСС, преимущественно при ППА от 10 до 30 с (Рис. 5Г).
Реагируя изменением энергетического баланса в ответ на сдвиги химизма крови, клетки аортальных и синокаротидных гломусов (периферические хеморецепторы) посылают импульсы в вазомоторный центр и таким образом вызывают перераспределительные реакции на уровне макрогемодинамики (Heymans С, Neil E., 1958). При этом, отчетливо проявляется реципрокность в фазных изменениях артериального давления и частоты сердечных сокращений (Wolk С etal., 1989).
При сохранности рефлекторной регуляции гипоксия, гиперкап-ния и гипоксическая гиперкапния приводили к значительному рефлекторному увеличению общего периферического сосудистого сопротивления (Васар Э.Ф., 1977; Коломиец Л.А., Вакслейгер Г.А., 1986; Adachi Н- et al., 1976; Cohn H.F. et al., 1980; Rothe Care F. et al., 1990). При этом, как обнаружил Л.А.Блумфелдс (1986), изменения ритма сердца являются вторичными по отношению к приросту артериального давления и реализуются рефлекторно через артериаль-
ные барорецепторы. По мнению автора, развитие гипоксии не играет значительной роли в осуществлении гемодинамической реакции на задержку дыхания.
Стимуляция артериальных хеморецепторов в условиях снижения их реактивности вызывает брадикардию, а при повышении их реактивности, наоборот, — тахикардию (McCloskey D.J., 1979; Coleridge J.C.G., Coleridge H.M., 1979; Daly M.B. et al., 1979; M.N.Levy, P.Y. Martin, 1988).
G.C.Lin et al. (1983) у здоровых людей выявили положительную линейную корреляцию между содержанием углекислого газа в альвеолах и ударным объемом сердца после 30 с задержки дыхания: при этом, усиление выброса сердца было связано с выбросом катехола-минов в ответ на гиперкапнию. Таким образом, регистрация изменений гемодинамических показателей во второй половине апноэ, и особенно в момент появления императивного стимула дыхания, позволяет верифицировать появление хеморефлексов.
В наших наблюдениях гемодинамические проявления прессорно-го хеморефлекса манифестировались увеличением САД и уменьшением ЧСС. При этом, проявлялись эффекты гуморальной активации как бета—адренорецепторов, на что указывали плавные изменения САД и УИ в сторону увеличения, а ЧСС и УПСС в сторону уменьшения, так и альфа—адренорецепторов сердца и сосудов, о чем свидетельствовало увеличение ЧСС, САД, У И и УПСС (Кассиль Г.Н., 1983; Сергеев П.В., Шимановский Н.Л., 1987; Шуба М.Ф., Кочема-соваН.Г., 1988).
1.3.4. Особенности оксигенации периферических тканей при разной длительности произвольного порогового апноэ
В настоящее время одним из важных показателей кислородо-транспортной функции крови у здоровых людей и у больных без грубых нарушений гемодинамики считается чрескожно определяемое напряжение кислорода— ткрОг (HuchR. et al., 1981; Shoemaker W.C., 1983; Coleman L.S. et al., 1986; Knudsen V.E. et al., 1987).
Анализ амплитудно—временных характеристик ткрОг во время пробы Штанге у здоровых и больных людей позволил дифференцировать пять типов оксигенации периферических тканей (Рис. б).
Отсутствие изменений ткрОг (рис. 6,1) во время задержки дыхания длительностью менее 30 с у здоровых и больных людей было обусловлено, прежде всего, достаточно большим латентным периодом изменений этого показателя, связанным с особенностями методики и равным 20—30 с (Coleman L.S.etal., 1986).
Увеличение ткрОг во второй половине апноэ (рис. 6,11) свидетельствовало об интенсификации периферического кровообращения, причиной которого могло быть усиление сердечного выброса у здоровых лиц и компенсированных больных (Prampero P.E., 1985)
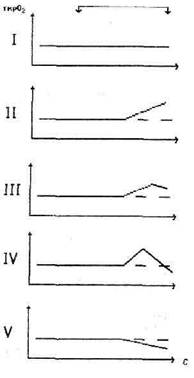
Рис. 6. Типовые изменения транскутанного напряжения кислорода во время пробы Штанге (I—V). По оси абсцисс — время (с); по оси ординат — ткр02; начало и конец пробы обозначены вертикальными стрелками.
или повышение сродства дыхательных ферментов к кислороду с целью улучшения оксигенации тканей в условиях нарастающей респираторной гипоксии у декомпенсированных больных (Иванов К.П., Лябах Е.Г., 1982; Вовненко Е.П., Иванов К.П., 1985).
В обоих случаях повышение ткрОг указывало на сохранность компенсаторных возможностей на уровне центральной гемодинамики (Вальдман А.В., 198!;ЗильберА.П., 1984; Johnson Р., 1982).
Согласно нашим представлениям, повышение ткрОг. переходящее в снижение этого показателя (рис. 6,111), у здоровых и больных людей можно считать проявлением оптимального состояния оксигенации периферических тканей.
Снижение ткрОг до исходных значений и ниже после предшествующего повышения величин этого показателя (рис. 6,IV) характеризовало начальные проявления недостаточности оксигенации периферических тканей (Ходас М.Я. и соавт., 1987; Hunt Т.К. el al., 1987).
Анализ динамики ткрОг во время пробы Штанге у декомпенсированных больных показал сопоставимость понижения величин этого показателя во второй половине апноэ относительно уровня фона (рис. 6,V) с истинной (вследствие декомпенсации сердечно—сосудистой системы) или регуляторной (медиаторно или гуморально опосредуемой) централизацией кровообращения, а также с углублением транзиторной периферической вазоконстрикции вследствие гуморальной активации альфа—адренорецепторов сердца и сосудов.
На зависимость снижения парциального давления кислорода в периферических тканях от синдрома "малого" выброса сердца и периферической вазоконстрикции указывали Г.А.Рябов (1979, 1987), А.П.Зильбер (1984), G. Thews (1960), P.E.Prampero (1985) и многие другие исследователи, работающие в области критических состояний в эксперименте и клинике.
В обобщенном виде характерные особенности состояния центральной гемодинамики и периферической оксигенации во время пробы Штанге у здоровых и больных людей с разной толерантностью к гиперкапнии и гипоксии приведены в таблице 6.
* * *
Таким образом, на основе изучения амплитудно—временных характеристик комплекса показателей функциональной системы дыхания у здоровых и больных людей были получены принципиально новые данные, раскрывающие особенности нейрорефлекторных и гуморальных механизмов обеспечения длительности ППА при пробе Штанге.
В наших исследованиях впервые обнаружены различия реактивности центральных и периферических хеморецепторов, барорсцеп-торов сосудов большого и малого кругов кровообращения, опосреду-
Таблица 6 Особенности нейрогуморальной регуляции кислородотранспортной функции при разной толерантности к гиперкапнии и гипоксии
| Уровни регуляции кислородотранспортной функции | Толерантность к гиперкапнии и гипоксии | |||
| Низкая | Умеренная | Высокая | Чрезмерно высокая | |
| I. Реактивность барорецеп-торов | Ареактивность или парадоксально высокая реактивность | Высокая, реже ареактивность | Оптимальная, реже высокая или низкая | Низкая или парадоксально высокая |
| II. Гемодинамические изменения, опосредуемые барорецепторами и периферическими хемо-рецепторами | Отсутствие изменений, рефлекс Бейнбриджа или депрессорный барорефлекс | Прессорный или депрессорный баро-рефлексы, реже рефлекс Ларина—Швигка; прессорный или депрессорный хемо-рефлексы | Рефлекс Ларина—Швигка, реже прессорный барорефлекс; прессорный хемо— рефлекс | Прессорный барорефлекс или рефлекс Ларина—Швигка; прессорный хемо— рефлекс |
| III. Тип периферической ок-сигенации | Усиление оксигенации, недостаточность оксигенации или сохранение исходной оксигенации | Усиление оксигенации, реже оптимальная окси- генация | Оптимальная оксигена-ция | Начальные признаки недостаточности оксигенации |
| IV. Состояние нейро-рефлекторной регуляции сердечно—сосудистой и дыхательной систем по данным омегаметрии | Ареактивность | Функциональная недостаточность | Оптимальное | Чрезмерное повышение активности |
емых ими гемодинамических рефлексов и состояний оксигенации периферических тканей.
Результаты анализа регуляторного и гомеостатического обеспечения различий реактивности центральных и периферических хе-морецепторов во время пробы Штанге явились объективным основанием для градации низкого, умеренного, высокого и чрезмерно высокого уровней толерантности к гиперкапнии и гипоксии.
Данные проведенных исследований позволили определить соотношения гиперкапнического и гипоксического факторов в генезе длительности произвольного порогового апноэ после глубокого вдоха. При этом, впервые установлено, что нормальные соотношения этих факторов на уровне систем регуляции и гомеостаза у здоровых лиц проявляются при вариациях длительности апноэ в достаточно широком диапазоне (от 35 до 90 с). У больных в компенсированном состоянии этот диапазон сужается за счет сдвига в сторону уменьшения длительности задержки дыхания до 30— 55 с; а у больных в декомпенсированном состоянии, наоборот, за счет сдвига в сторону увеличения длительности апноэ до 60—90 с.
Обнаруженные закономерности раскрывают отличия пластичности регуляторных и гомеопатических механизмов обеспечения толерантности к гиперкапнии и гипоксии при нормальных и патологических состояниях человека.
В частности, результаты наших исследований и данные литературы указывают на то, что нарушения соотношений между гипер-капническим и гипоксическим факторами происходят вследствие изменений интенсивности метаболической фиксации углекислого газа, и, в меньшей степени, зависят от исходного содержания углекислоты в выдыхаемой смеси и содержания оксигемоглобина при чрескожном его определении.
Такого рода модулирующие эффекты находили отражение в виде выхода длительности произвольного апноэ за вышеуказанные границы. В частности, при длительности произвольной задержки дыхания до 30 с исходная гипокапния заметно снижала толерантность испытуемых (особенно декомпенсированных больных) к гипоксиче-скому фактору. При длительности апноэ, более 90 с у здоровых лиц и более 60 с у компенсированных больных исходные нормо— и умеренная гиперкапния, напротив, достоверно повышали устойчивость даже к более выраженной по глубине гипоксии.
В дальнейшем феномен толерантности к гиперкапнии и гипоксии был использован нами для изучения физиологических механизмов, определяющих различия функциональных состояний (и связанной с ними стрессорной устойчивости) у здоровых и больных людей.
4!
ГЛАВА II
Каждый последующий этап развития естественных наук раскрывает исследуемые явления с той степенью глубины, на которую слот собна человеческая мысль и технико—методические возможности экспериментального подтверждения выдвигаемых гипотез. История развития физиологии торит путь к раскрытию общих и частных механизмов обеспечения приспособительных реакций, организации простых и сложных форм поведения животных и человека во всем многообразии их взаимодействия с факторами внешней среды.
Изучению причинно—следственных закономерностей внутри— и межсистемных взаимодействий в организме посвящены труды великих русских ученых И.М.Сеченова, В.М.Бехтерева, Л.А.Орбели, К.М.Быкова, А.Д.Сперанского и других.
Основополагающее учение И.П.Павлова о нервизме раскрывает диалектическое единство части и целого в изучении физиологии и патологии взаимодействия неразрывно связанных между собой органов и систем в организме животных и человека.
Проблема межорганных и межсистемных взаимодействий, как основа адаптивной регуляции функций и состояний организма, получила развитие в учении А.А.Ухтомского (1932) о доминанте.
Как отмечают А.С.Батуев и Л.П.Павлова (1984), концепция доминанты внесла в системную физиологию фактор, не учитываемый в других теориях: неравновесие как инвариантный структурно— функциональный принцип развивающихся живых систем.
Современные концепции организации сложных биологических систем рассматривают диалектику соотношений устойчивости и изменчивости как базисное свойство, обеспечивающее их жизнедеятельность. При этом, установлено, что свойство изменчивости служит приспособительным реакциям организма и, следовательно, защите его наследственно закрепленных жизненно важных констант. Адаптивная роль изменчивости реализуется колебаниями различного рода биологической активности, как универсальной формы постоянного, в том числе и опережающего, реагирования (Бауэр Э.С., 1935; Анохин П.К., 1962, 1975; Бехтерева Н.П., 1980, 1988; Илюхина В.А., 1986, 1990; Viner N.. 1968; Widington K.N., 1970).
Гомеостаз целой системы достигается не за счет стабилизации каждого компонента, а путем мультипараметрического регулирования (Шидловский В.А., Новосельцев В.Н., 1975; Шидловский В.А., 1978). Такой способ достижения гомеостаза является ведущим фак-
тором, определяющим вероятностный характер функционирования физиологической системы (ЧороянО.Г., 1983).
А.В.Завьялов (1990) указал на важное свойство биосистем — поддержание своих характеристик на постоянном уровне, нивелируя эффект возмущающих воздействий. Для оценки степени организованности автор рекомендует измерять способность системы стабилизировать свои характеристики.
Выбор подхода и методов исследования определяют границы познания принципов и механизмов регуляции функций, состояния отдельных систем и их взаимодействий в организации приспособительных реакций организма при различных стрессорных воздействиях.
Для решения одной из актуальных задач физиологии и патофизиологии функциональных состояний — стрессорной устойчивости человека — нами разработан комплексный подход (рис. 7).
Сущность предлагаемого подхода состоит в получении максимально полной информации об особенностях состояния основных регуляторных и гомеостатических систем, внутрисистемных взаимоотношений и интеграции межсистемных взаимодействий при разной толерантности к транзиторной гиперкапнии и гипоксии, определяющих различия функциональных состояний и стрессорной устойчивости у здоровых и больных людей.
Системный уровень физиологических исследований включал современные методы изучения функций и состояний центральной нервной системы (Бехтерева Н.П., 1971—1980; Илюхина В.А., 1977— 1990), вегетативной нервной системы (Ларин В.В., Баевский P.M., 1966; Баевский P.M. и соавт., 1984), внешнего и тканевого дыхания (Канаев Н.Н., 1980), центральной гемодинамики (Гундаров И.Л и соавт., 1983) и периферической оксигенации (Knudsen V.E. et al., 1987), кислотно—основного (Siggaard—Andersen О., 1974, 1980) и энергетического гомеостаза (Дембо А.Г., Крепе Е.М., 1966; McNeil G. et al., 1987) и неспецифической реактивности (Гаркави JI.X. и соавт., 1977, 1990).
Для исследования особенностей внутрисистемных взаимоотношений нами впервые введено понятие степени устойчивости исследованных системных показателей. В Таблице 7 представлены критерии устойчивости, умеренной вариабельности и неустойчивости показателей внешнего и тканевого дыхания, центральной гемодинамики и периферической оксигенации, энергетического и кислотно— основного гомеостаза в состоянии покоя в течение 10—минутного исследования (с дискретным шагом 10—30 с).
На основании выделенных критериев были исследованы особенности внутрисистемных реципрокных соотношений взаимосвязанных показателей при разной толерантности к транзиторной гиперкапнии и гипоксии у здоровых лиц и больных в компенсированном и дскомпенсированном состоянии.
| физиологические основы различий функциональных состояний человека | |||||||
| Субъективная оценка состояния, жалобы | ... j Данные физикального осмотра | ||||||
| СИСТЕМНЫЙ УРОВЕНЬ 1. Исследование функционального состояния основных регуляторных систем: - центральной нервной_системы; - вегетативной нервной системы; - внешнего дыхания; - центральной гемодинамики; 2. Состояние гомеостатических систем: - периферической оксигенации; - тканевого дыхания; - кислотно-основного гомеостаза; - энергетического гомеостаза; - неспецифической реактивности. | |||||||
| ВНУТРИСИСТЕМНЫЕ ВЗАИМООТНОШЕНИЯ Исследование вариабельности и характера реципрокных соотношений взаимосвязанных показателей: - - систем внешнего н тканевого дыхания; - центральной гемодинамики; - периферической оксигенации; - кислотно-основного и энергетического гомеостаза; | ИНТЕГРАЦИЯ МЕЖСИСТЕМНЫХ ВЗАИМОДЕЙСТВИЙ Сверхмедленные физиологические процессы: - в дифференцировании уровней бодрствования: - в изучении состояния механизмов компенсации; - в дифференцировании паттернов типовых реакций основных регуляторных систем на стресс-воздействие | ||||||
| НЕЙРОГУМОРАЛЬНЫЕ МЕХАНИЗМЫ ОБЕСПЕЧЕНИЯ РАЗЛИЧИЙ ТОЛЕРАНТНОСТИ К ГИПЕРКАПНИИ И гипоксии | |||||||
| различия переносимости нормальных и патологических стресс-воздействий | |||||||
Рис 7. Комплексный подход к изучению физиологических основ различий функциональных состояний и стрессорной устойчивости здорового и бояьного человека,
Таблица 7 Градация степеней устойчивости системных показателей в состоянии покоя здорового и больного человека
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 426; Нарушение авторских прав?; Мы поможем в написании вашей работы!