
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения концентрации растворов. Раствор – это гомогенная система переменного состава, состоящая из растворителя, растворенных веществ (одного или нескольких) и продуктов их взаимодействия
|
|
|
|
Теоретическая часть
Раствор – это гомогенная система переменного состава, состоящая из растворителя, растворенных веществ (одного или нескольких) и продуктов их взаимодействия. Компонент, который количественно преобладает и находится в том же агрегатном состоянии, что и образующийся раствор, называется растворителем, все остальные его части – растворенными веществами. Основным признаком, характеризующим раствор, является его однородность. Процесс растворения часто сопровождается значительными объемными и энергетическими эффектами. По этим признакам растворы больше напоминают химические соединения и тем самым отличаются от механических смесей. С другой стороны, растворы не имеют строго определенного состава, и в этом их существенное отличие от химических соединений.
Первоначально процесс растворения идет самопроизвольно (∆Gр-ния < 0) и раствор является ненасыщенным. При дальнейшем добавлении вещества наступает момент, когда вещество перестает растворяться, и тогда избыток растворенного вещества выпадает в осадок. Система оказывается в состоянии истинного равновесия (∆Gр-ния = 0), т.е. скорости осаждения и растворения равны. Раствор становится насыщенным. Можно получить и пересыщенные растворы, т.е. такие, массовые доли растворенных веществ в которых выше, чем в насыщенных растворах (при определенных температуре и давлении). Пересыщенные растворы можно приготовить медленным охлаждением насыщенных при высокой температуре растворов (например, Na2S2O3, NaCH3COO и др.). Они представляют систему, находящуюся в кажущемся равновесии (∆Gр-ния > 0). Встряхивание или внесение кристаллов того же вещества, которое находится в растворе или изоморфного с ним, вызывает кристаллизацию. В результате происходит выделение избытка растворенного вещества, и раствор становится насыщенным.
|
|
|
Состав любого раствора может быть выражен как качественно, так и количественно. Раствор с относительно низким содержанием растворенного вещества называют разбавленным, с относительно высоким – концентрирован-ным. Такая количественная оценка условна. Например, для серной кислоты концентрированным считается раствор, где массовая доля кислоты равна 98, а для соляной – 38 %.
Для количественной оценки состава растворов используют понятие «концентрация». Существуют различные способы ее выражения.
1. Массовая доля растворенного вещества в растворе. Она обозначается Wр.в. (по первой букве английского слова «Weight» – вес) и рассчитывается по формуле Wр.в. = 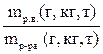 . Она выражается в долях от единицы и показывает, сколько граммов (кг, т) растворенного вещества содержится в 1 г (кг, т) раствора. Например, W
. Она выражается в долях от единицы и показывает, сколько граммов (кг, т) растворенного вещества содержится в 1 г (кг, т) раствора. Например, W 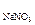 = 0,05. Это означает, что в каждом грамме (кг, т) раствора содержится 0,05 г (кг, т) растворенного вещества. Массовая доля растворенного вещества в растворе может быть выражена и в процентах: Wр.в. =
= 0,05. Это означает, что в каждом грамме (кг, т) раствора содержится 0,05 г (кг, т) растворенного вещества. Массовая доля растворенного вещества в растворе может быть выражена и в процентах: Wр.в. =  · 100 = Wр.в. · 100, %. В этом случае W указывает, сколько граммов (кг, т) растворенного вещества содержится в каждых 100 г (кг, т) раствора. Например, W
· 100 = Wр.в. · 100, %. В этом случае W указывает, сколько граммов (кг, т) растворенного вещества содержится в каждых 100 г (кг, т) раствора. Например, W 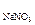 = 5 %: в каждых 100 г раствора содержится 5 г NaNO3 или в каждых 100 кг (т) раствора – 5 кг (т) NaNO3.
= 5 %: в каждых 100 г раствора содержится 5 г NaNO3 или в каждых 100 кг (т) раствора – 5 кг (т) NaNO3.
Раствор любой концентрации характеризуется своей плотностью ρ (г/мл; кг/л; г/л; т/м3), которая показывает, сколько граммов (кг, т) весит 1 мл (л, м3) раствора данной концентрации. Например, ρ = 1,02 г/мл. Это означает, что 1 мл раствора данной концентрации весит 1,02 г. Плотность раствора рассчитывается по формуле ρр-ра = 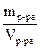 . Плотность (ρ) – это величина для перехода от массы раствора к его объему и наоборот.
. Плотность (ρ) – это величина для перехода от массы раствора к его объему и наоборот.
2. Молярная концентрация раствора (См). Ее значение показывает, сколько молей растворенного вещества содержится в 1 л раствора. Например, См (р-ра KCl) = 5 моль/л. Это означает, что в каждом литре такого раствора содержится 5 моль KCl. Молярная концентрация рассчитывается по формуле См = 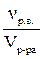 =
= 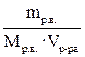 (моль/л), где νр.в. − количество растворенного вещества (моль); mр.в. – масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль), Vр-ра – объем раствора (л).
(моль/л), где νр.в. − количество растворенного вещества (моль); mр.в. – масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль), Vр-ра – объем раствора (л).
|
|
|
3. Молярная концентрация эквивалента раствора ( эквивалентная концентрация или нормальная концентрация). Она обозначается Сэ (используется также Сн). Ее значение показывает, сколько молей эквивалентов растворенного вещества содержится в 1 л раствора. Например, Сэ (р-ра HNO3) = 2 моль/л. Это означает, что в каждом литре раствора содержится 2 моль эквивалентов HNO3. Молярная концентрация эквивалента раствора рассчитывается по формуле Сэ =  =
= 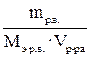 (моль/л).
(моль/л).
Растворы, имеющие одинаковые значения Сэ, реагируют между собой в равных объемах, так как содержат равные количества молей эквивалентов растворенных веществ. Если растворы имеют различные значения Сэ, то вступающие в реакцию объемы этих растворов обратно пропорциональны их молярным концентрациям эквивалента: 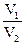 =
= 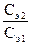 или V1 · Cэ 1 = V2 · Cэ 2.
или V1 · Cэ 1 = V2 · Cэ 2.
4. Моляльная концентрация раствора (Сm). Ее значение показывает, сколько молей растворенного вещества содержится в 1 кг растворителя. Например, Сm (р-ра H2SO4) = 10 моль/кг. Это означает, что в каждом килограмме воды растворено 10 моль H2SO4. Моляльная концентрация раствора рассчитывается по формуле: Сm =  =
= 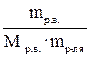 (моль/кг).
(моль/кг).
5. Молярная (мольная) доля растворенного вещества в растворе. Она обозначается χр.в.. Ее значение показывает, сколько молей растворенного вещества содержится в 1 моль раствора. Например, χ 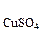 = 0,02. Это означает, что в 1 моль раствора содержится 0,02 моль CuSO4. Если в растворе только одно растворенное вещество, то χ
= 0,02. Это означает, что в 1 моль раствора содержится 0,02 моль CuSO4. Если в растворе только одно растворенное вещество, то χ  = 0,98. Сумма мольных долей всех компонентов в растворе равна единице, т.е. 1 моль. Мольная доля растворенного вещества в растворе рассчитывается по формуле χр.в. =
= 0,98. Сумма мольных долей всех компонентов в растворе равна единице, т.е. 1 моль. Мольная доля растворенного вещества в растворе рассчитывается по формуле χр.в. =  =
=  =
= 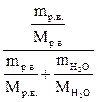 . Если в растворе несколько (К) растворенных веществ, то мольная доля любого из компонентов, в том числе растворителя, рассчитывается по формуле χi =
. Если в растворе несколько (К) растворенных веществ, то мольная доля любого из компонентов, в том числе растворителя, рассчитывается по формуле χi = 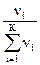 . Например, при наличии трех растворенных веществ и растворителя,
. Например, при наличии трех растворенных веществ и растворителя,
|
|
|
χ1 =  ; χ2 =
; χ2 = 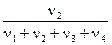 ; χ3 =
; χ3 =  ;
;
χ4 =  ; χ1 + χ2 + χ3 + χ4 = 1.
; χ1 + χ2 + χ3 + χ4 = 1.
6. Титр раствора. Этот вид выражения состава раствора обозначается буквой Т. Его значение показывает, сколько граммов растворенного вещества содержится в 1 мл раствора. Например, Т (р-ра Na2CO3) = 1,5 г/мл. Это означает, что в каждом миллилитре такого раствора содержится 1,5 г Na2CO3. Титр раствора рассчитывается по формуле Т = 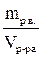 (г/мл).
(г/мл).
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 663; Нарушение авторских прав?; Мы поможем в написании вашей работы!