
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример. 1 моль молекул O2 содержит 4 моль эквивалентов кислорода
|
|
|
|
Пример.
m = M (O2); νэ =  = 4 моль.
= 4 моль.
1 моль молекул O2 содержит 4 моль эквивалентов кислорода.
Для сложных веществ Мэ и νэ могут быть рассчитаны по fЭ,который характеризует их в данной реакции.
Молярный объем эквивалента газообразного вещества (Vэ) (л/моль, м3/кмоль, м3/моль) – это объем, занимаемый 1 молем эквивалентов этого вещества.
Vэ= fЭ · Vm =  ; V
; V  = fЭ · V
= fЭ · V  =
=  .
.
V  (О2) =
(О2) = 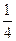 · 22,4 л/моль = 5,6 л/моль.
· 22,4 л/моль = 5,6 л/моль.
Это означает, что 1 моль эквивалентов О2 при н.у. занимает объем, равный 5,6 л.
V  (Н2) =
(Н2) = 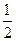 · 22,4 л/моль = 11,2 л/моль, т.е. 1 моль эквивалентов Н2 при н.у. занимает объем, равный 11,2 л.
· 22,4 л/моль = 11,2 л/моль, т.е. 1 моль эквивалентов Н2 при н.у. занимает объем, равный 11,2 л.
1 моль молекул О2 или 4 моля эквивалентов О2 при н.у. занимают объем 22,4 л; 1 моль молекул Н2 или 2 моля эквивалентов Н2 при н.у. занимают объем 22,4 л.
Закон эквивалентов: массы веществ, реагирующих друг с другом или образующихся в результате химической реакции, соотносятся между собой как их молярные массы эквивалентов.
 =
= 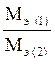 ;
; 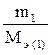 =
=  ;
;  = νэ (1);
= νэ (1);  = νэ (2).
= νэ (2).
νэ (1) = νэ (2) – количество эквивалентов каждого из участников химической реакции.
Для газообразного вещества
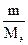 =
=  =
= 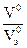 = νэ.
= νэ.
Закон эквивалентов для химической реакции с участием газа
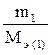 =
= 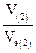 =
=  = νэ (1) = νэ (2).
= νэ (1) = νэ (2).
Мэ (1) =  .
.
Экспериментальное определение эквивалентов и молярных масс эквивалента различных веществ может быть проведено различными методами.
1. Метод прямого определения. Эквивалент и молярную массу эквивалента устанавливают исходя из соединений данного элемента с водородом или кислородом.
2. Косвенный метод, в котором вместо водорода и кислорода используют другие элементы и вещества с известным эквивалентом и молярной массой эквивалента.
3. Метод вытеснения водорода из кислоты металлом взятой навески. Применим к металлам, которые способны вытеснять водород из щелочей и разбавленных кислот.
4. Аналитический метод. Эквивалент определяют из результатов химического анализа элемента в одном из его соединений.
5. Электрохимический метод основан на законе Фарадея, согласно которому ≈ 96 500 Кл электричества выделяют из электролитов при электролизе 1 моль эквивалентов вещества.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1453; Нарушение авторских прав?; Мы поможем в написании вашей работы!