
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Если один элемент образует кислоты в разных положительных степенях окисления, то с ростом степени окисления повышаются сила кислоты и её устойчивость
|
|
|
|
С увеличением поляризующего действия центрального катиона сила и устойчивость кислот повышается.
Например, кислородные кислоты третьего периода в высшей степени окисления:
| SiO2∙xH2O | H3PO4 | H2SO4 | HClO4 |
| кремниевая | фосфорная | серная | хлорная |
| Si+4 | P+5 | S+6 | Cl+7 |
| слабая | средней силы | сильная | очень сильная |
| К1=2∙10-10 | К1=7,5∙10-3 | К1=1∙10+3 | К=1∙10+8 |
В ряду Si+4 – Cl+7 катионы имеют одинаковое электронное строение 2s22p6 (конфигурация Ne), но заряд ядра увеличивается, поэтому уменьшается радиус катиона. Одновременно происходит рост заряда, и всё это способствует резкому повышению поляризующего действия, и, как следствие, силы кислот.
Поскольку в подгруппе радиус атомов и ионов растёт, сила соответствующих кислот падает. Так, HN+5O3 сильнее, чем H3P+5O4.
Это можно объяснить ростом поляризующего действия катиона элемента (заряд растёт, радиус уменьшается). Связь Э – О становится короче и прочнее.
Рассмотрим кислородные кислоты хлора:
HClO HClO2 HClO3 HClO4
хлорноватистая хлористая хлорноватая хлорная
соли гипохлориты хлориты хлораты перхлораты
Cl+1 Cl+3 Cl+5 Cl+7
 Сила кислот
Сила кислот
 Устойчивость в водном растворе
Устойчивость в водном растворе
 Окислительная активность
Окислительная активность
По этим же причинам азотная кислота HNO3 устойчивее, чем азотистая HNO2, а серная H2SO4 – чем H2SO3.
Многие кислоты, отвечающие низким степеням окисления неметаллов, неустойчивы и существуют только в водном растворе:
H2SO3, HNO2, HClO, HClO2
Аналогично ведёт себя угольная кислота Н2СО3.
Среди кислородных кислот выделяют так называемые кислоты-окислители. В них при взаимодействии с металлами или другими восстановителями восстанавливается не водород Н+, а центральный катион неметалла. Типичный окислитель – концентрированная серная кислота H2SO4
(восстанавливается S+6 ):
3Cu + 2H2S+6O4(конц) = CuSO4 + S+4O2 + 2H2O
Аналогично ведёт себя азотная кислота любой концентрации:
3Сu + 8HN+5O3(33%) = 3Cu(NO3)2 + 2N+2O + 2H2O
Cu + 4HNO3(70%) = Cu(NO3)2 + 2N+4O2 + 2H2O
3Zn + 8HN+5O3(конц) = 3Zn(NO3)2 + 2N+2O + 4H2O
4Zn + 6HN+5O3(конц) = 4Zn(NO3)2 + N  O + 3H2O
O + 3H2O
Снижению степени окисления азота в продукте способствуют разбавление HNO3 азотной кислоты и увеличение активности металла. Zn цинк имеет электродный потенциал отрицательнее, чем медь Cu, поэтому он глубже восстанавливает азот N+5.
Ниже приведена схема взаимодействия азотной кислоты различной концентрации с металлами разной активности и указаны продукты её восстановления:
 концентрированная HNO3 разбавленная
концентрированная HNO3 разбавленная
 |  |  |  | ||||||
 | |||||||||
на Fe, Cr, Al, с другими с щелочными и c щелочноземельными c тяжёлыми
Au, Pt, Ir, Ta тяжёлыми щелочноземельными металлами и с Zn, Fe металлами



 не действует металлами металлами
не действует металлами металлами
NO2 N2O NH3(NH4NO3) NO



Соли азотной кислоты при нагревании разлагаются, причём продукты разложения зависят от положения солеобразующего металла в ряду стандартных электродных потенциалов:



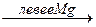 MeNO2 + O2
MeNO2 + O2
MeNO3  MeO + NO2 + O2
MeO + NO2 + O2

 Me + NO2 + O2
Me + NO2 + O2
Таким образом, соли металлов, расположенных в ряду левее Mg, при разложении образуют нитриты и кислород, от Mg до Cu – оксид металла, NO2 и кислород, после Cu – свободный металл, NO2 и кислород. Разложение при нагревании (термолиз) – важное свойство солей азотной кислоты.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 670; Нарушение авторских прав?; Мы поможем в написании вашей работы!