
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химия d-элементов
|
|
|
|
Характерная особенность атомов элементов побочных подгрупп – заполнение внутреннего (n-1)d – подуровня, происходящее после заполнения ns–подуровня. Поэтому элементы побочных подгрупп часто называют переходными элементами (расположены в длиннопериодном варианте Периодической системы между s-элементами слева и p-элементами справа). Общая электронная конфигурация d-элементов (n-1)d0¸10ns0¸2.
Все переходные элементы – металлы с высокой плотностью; большинство из них отличается большой твёрдостью, теплопроводностью и электропроводностью. Все они каталитически активны и парамагнитны.
Элементы побочных подгрупп отчасти схожи с элементами соответствующих главных подгрупп. Сходство в наибольшей степени проявляется у элементов III группы, где только начинается заполнение (n-1)d – подуровня. С возрастанием порядкового номера d-элемента в группе и номера самой группы (начиная с 3-ей группы) сходство уменьшается и в восьмой группе почти совсем исчезает. В первой группе вновь появляется отдалённое сходство элементов обеих подгрупп, а во второй – сходство весьма сильное.
Общим свойством соединений почти всех d-элементов является переменная степень окисления. Сначала на связь уходят s-электроны, потом d-электроны по одному. У 3d-элементов низшие степени окисления более стабильны, чем высшие; у 4d- и 5 d-элементов – наоборот, высшие степени окисления более стабильны. 3d-элементы – кайносимметрики – первый раз заполняется d-оболочка, поэтому их свойства отличаются от свойств остальных d-элементов.
Т.к. на внешнем слое у большинства d-элементов находятся два s-электрона, то они проявляют степень окисления +2. Высшая степень окисления у элементов, не содержащих на орбиталях пар d-электронов (III-VIIгруппы) вплоть до Mn, соответствуют номеру группы. Для элементов VIII группы, у которых d-орбитали имеют электронные пары (т.е. распаривать спаренные электроны некуда), высшие степени окисления нехарактерны. Соединения побочного элемента данной подгруппы с высшей степенью окисления напоминают соответствующие соединения элементов главной подгруппы в той же степени окисления (CrO3 – SO3, MnO4- - ClO4- и др.); но сходство полностью исчезает, когда d-элемент находится не в высшей степени окисления. У переходных элементов стабильность высших степеней окисления вниз по группе повышается, а у непереходных элементов – понижается.
В связи с переменными степенями окисления для большинства d-элементов характерны окислительно-восстановительные реакции. Строение и свойства соединений зависят от степени окисления атомов.
В низких степенях окисления для d-элементов характерны восстановительные свойства, например для соединений Mn(II):
2Mn(NO3)2 + 6HNO3 + 5PbO2 = 2HMnO4 + 5Pb(NO3)2 + 2H2O
4Mn(OH)2 +O2 = 4MnO(OH)↓ + 2H2O
Mn(OH)2 + H2O2(конц.) = MnO2↓ + 2H2O
В высоких степенях окисления для d-элементов характерны окислительные свойства, например, для соединений марганца (VII):
2KMnO4 + 8H2SO4 + 10KJ =2MnSO4 + 5I2↓ + 8H2O + 6K2SO4
2KMnO4 + 2H2O + 3MnSO4 = 5MnO2↓ + 2H2SO4 + K2SO4
2KMnO4 + 3H2S = 2MnO2↓ + 3S↓ + 2H2O + 2KOH
2KMnO4 + 2KOH(конц.) + K2SO3 = 2K2MnO4 + H2O + K2SO4
В промежуточных степенях окисления соединения d-элементов играют роль и окислителей, и восстановителей, что характерно, например, для соединений хрома (III):
Cr2(SO4)3 + 2H0(Zn, разб. H2SO4) = 2CrSO4 + H2SO4
2Na3[Cr(OH)6] + 4NaOH + 3Br2 = 2Na2CrO4 + 6NaBr + 8H2O
Анализ изменения кислотно-основных свойств соединений d-элементов показывает, что с повышением степени окисления основные свойства элемента уменьшаются, а кислотные свойства возрастают. В высоких степенях окисления кислотные свойства ярко выражены, а атом элемента служит кислотообразователем: Cr+2 обладает основными свойствами, Cr+3 – типично амфотерными (подобно алюминию), Cr+6 – кислотными.
Усиление основных свойств
Усиление восстановительных свойств

 MnO Mn2O3 MnO2 MnO3 Mn2O7
MnO Mn2O3 MnO2 MnO3 Mn2O7

Усиление кислотных свойств
Усиление окислительных свойств
Большинство d-элементов легко реагируют с кислотами – неокислителями (исключения: Cu, Ag, Au, Hg, металлы семейства платины), например:
Mn + H2SO4 = MnSO4 + H2↑
Кислоты-неокислители переводят железо в его соли (FeCl2, FeSO4), а в концентрированных H2SO4 и HNO3 происходит пассивация. Разбавленная азотная кислота окисляет железо до состояния (+III):
Fe + 4HNO3(разб.) = Fe(NO3)3 + NO↑ + 2H2O
На поверхности хрома образуется оксидная плёнка Сr2O3, поэтому хром в разбавленных серной и соляной кислотах начинает растворяться не сразу, а после растворения оксидной плёнки:
Cr + 2HCl = CrCl2 + H2↑
В азотной и концентрированной серной кислотах хром не растворяется, как как его плёнка упрочняется и хром переходит в пассивное состояние. Некоторые малоактивные металлы (Au, Pt) окисляются царской водкой, а наиболее устойчивые вообще не реагируют с кислотами (Ru, Rh, Ir):
Au + HNO3 + 4HCl= H[AuCl4] + NO↑ + 2H2O
Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO↑ + 8H2O
При нагревании все d-металлы реагируют с галогенами, серой и другими неметаллами.
2Cr + N2 =CrN Cr + Si = CrSi
2Cr + 3S = Cr2S3 Cr + 2HF = CrF2 + H2↑
Так, при высокой температуре хром и железо ярко горят в кислороде, образуя соответствующие оксиды:
4Cr + 3O2 = 2Cr2O3
3Fe + 2O2 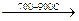 Fe3O4
Fe3O4
Раскалённые металлы реагируют с парами воды:
3Fe + 4H2O = Fe3O4 + 4H2↑
2Cr + 3H2O = Cr2O3 + 3H2↑
Большинство соединений элементов побочных подгрупп имеют характерные окраски.
Соединения железа (II) проявляют сильные восстановительные свойства (Fe+2 → Fe+3) и устойчивы только в инертной атмосфере. Они окисляются медленно на воздухе или быстро в водном растворе при действии окислителей в соединения железа (+3), окрашенные в жёлтый цвет:
6FeO+O2 
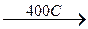 2(Fe2+Fe23+)O4 4(Fe2+Fe23+)O4 +O2
2(Fe2+Fe23+)O4 4(Fe2+Fe23+)O4 +O2 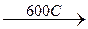 6Fe2O3
6Fe2O3
2Fe(OH)2 + H2O2 = 2FeO(OH)↓ + 2H2O
Fe(OH)2 + NaNO2 = FeO(OH)↓ +NO↑ + NaOH
FeSO4 + 4HNO3(конц.) = Fe(NO3)3 + H2SO4 + NO2↑ + H2O
5FeCl2 + 8HCl(разб.) + KMnO4 = 5FeCl3 + MnCl2 + 4H2O + KCl
Соединения железа (III) довольно устойчивы к окислению и восстановлению. При действии сильных восстановителей Fe2O3 и FeO(OH) переходят в Fe, а соли железа (III) в водном растворе – в соли железа (II):
Fe2O3 + 3H2 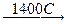 2Fe + 3H2O
2Fe + 3H2O
2FeO(OH) + 3H2 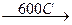 2Fe + 4H2O
2Fe + 4H2O
2FeCl3 + 2KI = 2FeCl2 + I2↓ + 2KCl
Fe2(SO4)3 + 2H0(Fe, разб.H2SO4) = 2FeSO4 + H2SO4
При действии очень сильных окислителей соединения железа (III) переходят в соединения железа (VI) – ферраты (содержат анион FeO42-):
2FeO(OH) + 10KOH(конц.) + 3Br2 = 2K2FeO4 + 6H2O + 6KBr
Ферраты устойчивы только в сильнощелочной среде; при понижении щелочности они становятся сильными окислителями, при кипячении легко окисляют даже оксидный кислород и аммиачный азот:
4 FeO42- + 6H2O = 4FeO(OH)↓ + 8OH- + 3O2↑
4 FeO42- + 20H+ = 4Fe3+ + 10H2O + 3O3
2K2FeO4 + 2(NH3∙H2O) = 2FeO(OH)↓ + 2H2O + 4KOH + N2↑
Все соединения хрома (II) неустойчивы и легко окисляются кислородом воздуха в соединения хрома (III), например:
2Cr(OH)2 + 1/2O2 + H2O ↔ 2Cr(OH)3
Оксид хрома (III) Cr2O3 – тугоплавкий порошок зелёного цвета получается с помощью взаимодействия элементов при высокой температуре или в лаборатории при нагревании дихромата аммония:
(NH4)2Cr2O7 = Cr2O3 + N2↑ + 4H2O
При сплавлении со щелочами образуются соединения хрома (III) – хромиты:
Cr2O3 + 2NaOH = 2NaCrO2 + H2O
Гидроксид хрома(III) обладает амфотерными свойствами – реагирует и с кислотами, и со щелочами. При растворении в кислотах образуются соли хрома (III), например:
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
При растворении Cr(OH)3 в щелочах образуются гидроксохромиты:
Cr(OH)3 + NaOH + 2H2O = Na[Cr(OH)4(H2O)2]
Cr(OH)3 + OH- + 2H2O = [Cr(OH)4(H2O)2]-
При сплавлении Cr(OH)3 со щелочами получают метахромиты и ортохромиты:
Cr(OH)3 + NaOH = NaCrO2 + 2H2O Cr(OH)3 + 3NaOH = Na3CrO3 + 3H2O
При прокаливании гидроксид хрома(III) образует оксид хрома (III):
2 Cr(OH)3 = Cr2O3 + 3H2O
Оксид хрома (VI) – тёмно-красное кристаллическое вещество, сильный окислитель: окисляет йод, серу, фосфор, уголь, превращаясь при этом в оксид хрома (III), например:
3S + 4CrO3 = 3SO2 + 2Cr2O3
При нагревании разлагается:
4CrO3 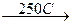 2Cr2O3 + 3O2
2Cr2O3 + 3O2
Получается при взаимодействии концентрированной серной кислоты с насыщенным раствором дихромата калия:
K2Cr2O7 + H2SO4 = 2CrO3↓ + K2SO4 + H2O
CrO3 имеет кислотный характер: легко растворяется в воде, образуя хромовые кислоты. С избытком воды образует хромовую кислоту:
CrO3 + Н2О = H2CrO4
При высокой концентрации CrO3 образуется дихромовая кислота:
2 CrO3 + H2O = H2Cr2O7,
которая при разбавлении переходит в хромовую кислоту:
H2Cr2O7 + H2O = 2H2CrO4
Ионы  CrO
CrO 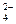 и Cr2O
и Cr2O  превращаются друг в друга при изменении концентрации ионов водорода по уравнениям:
превращаются друг в друга при изменении концентрации ионов водорода по уравнениям:
2 CrO 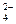 + 2H+ ↔ Cr2O
+ 2H+ ↔ Cr2O  + H2O
+ H2O
Cr2O  + 2OH- ↔ 2 CrO
+ 2OH- ↔ 2 CrO 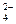 + H2O
+ H2O
Соли хромовых кислот в кислой среде – сильные окислители, например:
3SO2 + K2Cr2O7 + H2SO4 = K2SO4 + Cr2(SO4)3 + H2O
Соединения хрома (III) в щелочной среде играют роль восстановителей. Под действием различных окислителей – Cl2, Br2, H2O2, KMnO4 и др. – они переходят в соединения хрома (IV) – хроматы:
2Na[Cr(OH)4(H2O)2] + 3Br2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8H2O
Сильные окислители, такие, как КMnО4, (NН4)2S2О8, в кислой среде переводят соединения Сr(III) в дихроматы:
Cr2(SO4)3 + 2KMnO4 + 7H2O = K2Cr2O7 + 2Mn(OH)4 + 3H2SO4
Задания для самостоятельной работы
Задача 8. Напишите все возможные молекулярные уравнения реакций между веществом из столбца 1 и веществами из столбца 2, дайте названия исходным веществам и продуктам реакции, укажите условия протекания химических реакций
| Номер варианта | Формула веществ | |
| CO2 | 1) HCl, 2) H2O, 3) KOH, 4) CaCO3 + H2O, 5) MgO; | |
| Fe(OH)2 | 1) CaO, 2) H2SO4, 3) KOH, 4) O2 + H2O, 5) SO3 (t˚); | |
| K2CO3 | 1) HClO4, 2) H2O, 3) KOH, 4) HBr, 5) FeO; | |
| HCl | 1) Cu, 2) NH4OH, 3) Cu(OH)2, 4) K2SO4, 5) FeO; | |
| CaO | 1) HNO3, 2) H2O, 3) KOH, 4) SO2, 5) Ca(HCO3)2 | |
| KHCO3 | 1) H2SO4, 2) K2O, 3) KOH, 4) CO2, 5) Ca; | |
| KOH | 1) HClO, 2) Ca(OH)2, 3) CuSO4, 4) CO2, 5) Al(OH)Cl2; | |
| HClO4 | 1) SO3, 2) FeO, 3) MnSO4, 4) HNO3, 5) NaOH; | |
| FeO | 1) H2SO4, 2) Al2O3, 3) K2CO3, 4) CO2, 5) KOH; | |
| Al(OH)Cl2 | 1) HCl, 2) H2O, 3) NaOH, 4) K2CO3, 5) CO2; | |
| Cl2 | 1) Н2О, 2) КОН (горячий раствор); 3) HBr; 4) FeCl2; 5) Br2 | |
| Na2SO3 | 1) HCl, 2) BaCl2, 3) KOH, 4) CaSO4, 5) SO3; | |
| H2SO3 | 1) HCl, 2) CaCl2, 3) KOH, 4) SO2, 5) BaO; | |
| Al2O3 | 1) H2SO4, 2) CaO, 3) KOH, 4) SO2, 5) K2SO4; | |
| NaOH | 1) ZnO, 2) SO2, 3) KHCO3, 4) Al(OH)Cl2, 5) H2S; | |
| CuSO4 | 1) H2S, 2) BaCl2, 3) KOH, 4) HNO3, 5) CO2; | |
| Al(OH)3 | 1) HClO4, 2) KCl, 3) KOH, 4) CaO + t˚, 5) CO2; | |
| ZnO | 1) H2SO4, 2) H2O, 3) NaOH, 4) CaO, 5) K3PO4 | |
| H2SO4 | 1) KCl, 2) K2O, 3) Zn(OH)2, 4) CO2, 5) Zn; | |
| NaOH | 1) HCl, 2) Ba(OH)2, 3) Al(OH)2Cl, 4) FeCl2, 5) SO2; | |
| CaO | 1) HCl, 2) CuSO4, 3) FeO, 4) CO2, 5) Al2O3; | |
| BeO | 1) HCl, 2) H2O, 3) NaOH, 4) K2O, 5) NaCl; | |
| N2O5 | 1) NaCl, 2) H2O, 3) KOH, 4) CaO, 5) CO2; | |
| HBr | 1) Zn, 2) KOH, 3) SO3, 4) FeO, 5) H2SO4; | |
| КОН | 1) Al, 2) H2O, 3) H3PO4, 4) SO2, 5) FeCl2; | |
| MgO | 1) HNO3, 2) H2O, 3) NaOH, 4) SO2, 5) Ca(HCO3)2; | |
| H2SO3 | 1) NaCl, 2) K2O, 3) Zn(OH)2, 4) CO2, 5) Zn; | |
| Номер варианта | Формула веществ | |
| K2SO3 | 1) HClO4, 2) H2O, 3) Ba(OH)2, 4) HBr, 5) FeO; | |
| HNO3 (разб) | 1) Fe, 2) NH4OH, 3) Cu(OH)2, 4) K2SO4, 5) FeO; | |
| H2O | 1) K2O, 2) CO2, 3) MnCl2, 4) Al2O3, 5) H2SO4; |
Задача 9. Составьте уравнения реакций, протекающих в цепи превращений; укажите условия протекания реакций; дайте название исходным веществам и продуктам химических реакций.
| Номер варианта | Цепочка превращений |
| NaCl → Na2CO3 → NaHCO3 → NaCl → Na | |
| FeS2 → SO2 → SO3 →CaSO4 → Ca(HSO4)2 | |
| Ca → CaO → Ca(OH)2 →CaCO3 → Ca(HCO3)2 →CO2 | |
| KOH → KAlO2 → Al(OH)3 →Al2O3 →AlPO4 | |
| Al → Al(OH)3→ Al2O3 → Al →Al2S3 →AlCl3 | |
| K2CO3 →K2SO4 →KCl → Cl2 →CaCl2 | |
| Fe →FeS →FeCl2 →FeCl3 →Fe(OH)3→Fe2O3 | |
| Ca →CaCl2 →Ca(OH)2 →Ca(NO3)2 →CaCl2 | |
| Na2CO3 →NaCl → NaOH →NaHCO3 →CO2 | |
| Zn →ZnS →ZnCl2 →ZnO →ZnSO4 → Zn(OH)2 | |
| Cu →Cu(NO3)2 →CuO →Cu SO4 →Cu →Cu(OH)2 | |
| Ca → CaO → Ca(NO3)2 → Ca(OH)2→ CaSiO3 | |
| Na → NaCl →Na2CO3 →NaHCO3 →Na2CO3 | |
| O2→ SiO2→ Si → Mg2Si → SiH4 | |
| N2 → NH3 → HNO3 →Mg(NO3)2→Мg | |
| (NH4)2Cr2O7 →Cr2O3 → NaCrO2 →Cr2(SO4)3→Cr | |
| HCl → Cl2 →KClO3 →KCl → AgCl | |
| Fe2O3 ↔Fe(OH)3 → Fe2(SO4)3 → Fe → FeCl2 | |
| FeS2 → Fe(OH)3 →Fe(SO4)3 →FeCl3 →Fe2O3 | |
| Pb(NO3)2 → HNO3 → NH4NO3 → N2 → NH3 | |
| Ca3(PO4)2 →Ca(H2PO4)2 → CaSO4 → CaS →CaCO3 | |
| Номер варианта | Цепочка превращений |
| NH3 → NH4Cl → HCl→ Cl2→ KClO3 | |
| NaNO3 →NaNO2 → N2 → NO→Ba(NO3)2 | |
| Na2SO3 → S → Al2S3 → H2S →SO2 | |
| Pb(NO3)2 → HNO3 →NH4 NO3 →N2O | |
| Ba(NO3)2 →BaCl2 →BaSO4 →BaS →H2S →S | |
| KNO3 →KCl → KClO3 → KCl → K2SO4 | |
| KClO3 →KCl →HCl → CaCl2 →CaSO4 | |
| FeS2 → H2SO4 → SO2 → KHSO3 | |
| NH4Cl → NH4 NO3 → NH3 → NO →Fe(NO3)3 |
Задача 10. Ответьте на следующие вопросы:
1. Нахождение в природе и получение в свободном виде
2. Положение в периодической системе, электронная конфигурация атома, графическое изображение валентных электронов нормальном и возбужденном состояниях, валентность, примеры соединений в устойчивых степенях окисления
3. Физические и химические свойства элемента
4. Роль в жизнедеятельности человека
| Номер варианта | Элемент | Номер варианта | Элемент | Номер варианта | Элемент |
| С | Cl | Мо | |||
| N | К | Ag | |||
| О | Са | Au | |||
| F | Мn | I | |||
| Na | Fe | Сr | |||
| Mg | Co | As | |||
| Al | Ni | В | |||
| Si | Сu | Sn | |||
| S | Zn | Рt | |||
| Р | Br | Pb |
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1639; Нарушение авторских прав?; Мы поможем в написании вашей работы!