
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химия s- и p-металлов
|
|
|
|
Простые вещества элементов первой группы главной подгруппы называются щелочными металлами. Это блестящие, мягкие, лёгкие, тепло- и электропроводные металлы. Атомы на внешнем энергетическом уровне имеют по одному электрону ns1. При химическом взаимодействии они отдают валентные электроны, проявляя постоянную степень окисления, равную +1. Электроотрицательность щелочных металлов очень низка, а Cs и Fr – самые электроположительные элементы (χ=0,86), что обусловливает их существование в виде однозарядных катионов, образующих соли или солеобразные бинарные соединения. Все щелочные металлы – сильные восстановители. Они являются самыми активными металлами, непосредственно соединяются почти со всеми неметаллами – галогенами, серой, фосфором и др. В соединениях преобладает ионная связь.
2M + Hal2 = 2MHal (при нагревании)
Элементы подгруппы лития образуют с кислородом оксиды. На воздухе они легко окисляются, поэтому их хранят под слоем керосина. Взаимодействие металлов I группы с кислородом ведёт к образованию разных оксидов в зависимости от природы металла и условий реакции:
4Li + O2 = 2Li2O
При сгорании натрия в избытке кислорода образуется пероксид натрия:
2Na + O2 = Na2O2 (пероксид О22-)
K(Rb) + O2 = KO2 (надпероксид или супероксид О2-)
Склонность к образованию пероксидов и надпероксидов увеличивается вниз по группе.
Оксиды с водой образуют основания:
R2O + H2O = 2ROH
При сгорании натрия в избытке кислорода образуется пероксид натрия, который взаимодействует с влажным углекислым газом воздуха, выделяя кислород:
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
Металлы бурно реагируют с водой с образованием щелочи и водорода. Щелочные металлы образуют много бинарных соединений, самые известные из них нитриды M3N, карбиды M2C2, гидриды MH, все они энергично разлагаются водой. С водородом при нагревании образуют гидриды RH –белые кристаллические вещества, в которых степень окисления водорода равна -1. Гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
NaH + H2O = NaOH + H2↑
Li3N + 3H2O = 3LiOH +NH3↑
Na2C2 + 2H2O = 2NaOH + C2H2↑
Твёрдые гидроксиды натрия и калия и их водные растворы поглощают оксид углерода (IV):
NaOH + CO2 = NaHCO3
2NaOH + CO2 = Na2CO3 + H2O
Карбонаты и гидроксиды элементов I группы не разлагаются при нагревании, но:
Li2CO3 → Li2O + CO2 2LiOH → Li2O + H2O
Нитраты элементов I группы разлагаются до нитритов, а литий – до оксида:
2MNO3 → 2MNO2 + O2 4LiNO3→ 2Li2O + 4NO2 +O2
Во IIA-группу Периодической системы входят элементы Be, Mg, Ca, Sr, Ba, Ra. Ca, Sr, Ba, Ra имеют групповое название щелочноземельные металлы.
На валентном уровне два электрона (общая электронная конфигурация ns2), характерная степень окисления +2. Электроотрицательность элементов в этой группе различна; она довольна высока для Be (χ=1,47), что обусловливает его амфотерное поведение, и типично металлическая у остальных элементов.
Все металлы подгруппы – сильные восстановители, однако несколько более слабые, чем щелочные металлы. Химическая активность увеличивается с ростом порядкового номера. На воздухе окисляются, при этом получаются основные оксиды типа RO, которым соответствуют основания типа R(OH)2. Растворимость и основной характер оснований возрастают от Ве к Ra. Ве(ОН)2 – амфотерное соединение.
По свойствам бериллий и магний несколько отличаются от остальных металлов. Так, Ве с водой не взаимодействует, Mg взаимодействует лишь при нагревании, а остальные металлы – при обычных условиях:
R + 2H2O = R(OH)2 + H2↑
Все металлы обладают большим сродством к неметаллам: с кислородом они образуют оксиды МО, с водородом гидриды – МН2, с азотом – нитриды M3N2, с галогенами – галогениды МHal2, с углеродом – карбиды МС2, с серой – сульфиды MS и т.д.
На воздухе кальций окисляется, поэтому его хранят в закрытых сосудах под слоем керосина. При обычных условиях кальций реагирует с галогенами, а с серой, азотом и углеродом – при нагревании:
Са + Cl2 = CaCl2 3Ca + N2 = Ca3N2
Ca + S = CaS Ca + 2C = CaC2
Гидриды элементов II группы образуются при взаимодействии соответствующих металлов с водородом при высоких температурах:
Ва + Н2 =ВаН2
За исключением ВеН2, гидриды других s-элементов бурно гидролизуются с выделением Н2:
СаН2 + 2Н2О = Са(ОН)2 + 2Н2 ↑
Будучи активным металлом, Са вытесняет водород из воды:
Ca + 2H2O = Ca(OH)2 + H2↑
При нагревании на воздухе сгорает, образуя оксид кальция:
2Ca + O2 = 2CaO
Оксид кальция (негашёная известь) энергично взаимодействует с водой с образованием гидроксида кальция (гашёная известь):
СaO + H2O = Ca(OH)2
При пропускании через известковую воду оксида углерода (IV) раствор мутнеет, а при дальнейшем пропускании муть исчезает:
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O CaCO3 + H2O + CO2 = Ca(HCO3)2
Ca2+ + 2OH- + CO2 = CaCO3↓ + H2O CaCO3 + H2O + CO2 = Ca2+ + 2HCO3-
IIIA-группу составляют элементы бор, алюминий, галлий, индий и таллий. Электронная конфигурация ns2np1, откуда характерная с.о. +3 (бор также -3), хотя для таллия более устойчивой является степень окисления +1. Элементы подгруппы относятся к р-элементам. Электроотрицательность элементов невысока (от 2,01 для В до 1,44 для Тl).
Металлический характер элементов возрастает от В к Тl; по химическим свойствам бор - неметалл, Al, Ga и In – амфотерные элементы с усилением основных свойств от Al к Tl; Tl – металл, для которого более устойчивой и распространённой является степень окисления +1, например, в соединениях Tl2O, TlOH, Tl2CO3, TlCl. Все элементы – сильные восстановители.
Все элементы подгруппы бора образуют оксиды типа R2O3. Им соответствуют гидроксиды типа R(OH)3. Кроме бора в водных растворах они находятся в виде гидратированных ионов R3+. Бор – кислотообразующий элемент.
Алюминий легко соединяется с кислородом уже при обычной температуре. При этом поверхность его покрывается оксидной плёнкой Al2O3, предохраняющей материал от дальнейшего окисления и придающей ему матовый вид. Благодаря ей алюминий не корродирует под воздействием влаги и воздуха.
При разрушении оксидной плёнки алюминий взаимодействует с водой:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
В обычных условиях алюминий не взаимодействует с концентрированной и сильноразбавленной азотной кислотой, однако растворяется в соляной и серной кислотах:
2Al + 6H+ = 2Al3+ + 3H2↑
На алюминий сильно действуют растворы щелочей:
2Al + 2NaOH +10H2O = 2Na[Al(OH)4(H2O)2] + 3H2↑
2Al +2OH- + 10H2O = 2[Al(OH)4(H2O)2]- + 3H2↑
При нагревании алюминий реагирует с галогенами, а при высокой температуре – с серой, азотом и углеродом:
2Al + 3Cl2 = 2AlCl3 2Al + N2 = 2AlN
2Al + 3S = Al2S3 4Al + 3C = Al4C3
На воздухе при поджигании алюминий восстанавливает многие металлы из их оксидов (алюминотермия):
2Al + Cr2O3 = Al2O3 + 2Cr 10Al + 3V2O5 = 5Al2O3 + 6V
Оксид алюминия Al2O3 (минерал корунд, техническое название глинозем) представляет собой белый порошок или очень твёрдые белые кристаллы, тугоплавкий (tпл=2055°С). После длительного прокаливания очень медленно реагирует с кислотами и щелочами в водном растворе, но легко реагирует со щелочами в расплаве:
a) Al2O3 +6HCl(конц., гор.) = 2AlCl3 + 3H2O;
б) Al2O3 + 2NaOH (конц., гор.) + 3H2O = 2Na[Al(OH)4],
Al2O3 + NaOH 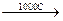 2NaAlO2.
2NaAlO2. 
Помимо сырья для производства алюминия, Al2O3 в виде порошка служит абразивным материалом, а в виде кристаллов применяется для изготовления лазеров и синтетических драгоценных камней (рубинов, сапфиров и др.), окрашенных примесями оксидов других металлов – Cr2O3 (красный цвет), Ti2O3 и Fe2O3(голубой цвет) и т.д.
Гидроксид алюминия Al(OH)3 – белый рыхлый порошок, при 200°С разлагается, теряя H2O, и образует метагидроксид AlO(OH), при который при прокаливании полностью обезвоживается до Al2O3.
Гидроксид алюмния амфотерен:
Al3+  Al(OH)3↓
Al(OH)3↓  [Al(OH)4]-
[Al(OH)4]-
Соли алюминия и cильных кислот хорошо растворимы в воде и подвергаются в значительной степени гидролизу по катиону, создавая сильнокислую среду,в которой растворяются такие металлы, как магний и цинк:
а) AlCl3→ Al3+ + 3Cl-
Al3+ + H2O ↔ AlOH2+ + H+ pH<<7;
б) Zn + 2H+ = Zn2+ + H2↑.
Элементы IVA-группы Ge, Sn, Pb относятся к амфотерным элементам, металлические свойства которых возрастают с увеличением порядкового номера и уменьшением степени окисления. Электронная конфигурация внешнего уровня их атомов ns2np2. В соединениях эти элементы проявляют характерные степени окисления (+II) и (+IV).
В соединениях со степенью окисления (+IV) связи ковалентные, например в жидких хлоридах GeCl4, SnCl4, PbCl4, тогда как в соединениях свинца (+II) связи ионные и вещества PbF2, PbSO4 и Pb(NO3)2 являются солями (ионными кристаллами).
Устойчивость соединений в степени окисления (+IV) уменьшается при переходе от Ge к Pb, а устойчивость соединений в степени окисления (+II) возрастает. Так, соединения свинца Pb4+ - очень сильные окислители, например, оксид свинца (IV):
PbO2 + 4H+ +2e = Pb2+ + 2H2O pH<7
PbO2 + 2H2O + 2e = [Pb(OH)4]2- pH>7
Оксид свинца (IV) реагирует с концентрированной соляной кислотой с выделением газообразного хлора Cl2 и образованием хлоридов свинца (IV).
PbO2 + 4HCl = PbCl2 + Cl2 ↑+ 2H2O
Соединения остальных элементов в степени окисления (+II) – это сильные восстановители, например, SnCl2 и др.
В свободном виде элементы IVA-группы – твёрдые простые вещества, металлический характер которых возрастает от Ge к Pb. По физическим свойствам германий является полупроводником, а олово и свинец – типичные металлы, т.е. проводники. В ряду напряжений Sn и Pb стоят непосредственно перед водородом.
Оксиды и гидроксиды (безводные и гидратированные) этих элементов амфотерны; причём у соединений элементов (IV) преобладают кислотные свойства, а у соединений элементов (II) – основные свойства:
а) GeO2 + 4HCl(конц.)= GeCl4 + 2H2O,
GeO2∙nH2O + 2NaOH(конц.)= Na2GeO3 + (n+1)H2O;
б) PbO +2HCl(разб.) = PbCl2↓ + H2O,
Pb(OH)2 + 2NaOH(конц.)= Na2[Pb(OH)4].
Стабильность низших оксидов растёт вниз по группе.
Устойчивость водородных соединений группы понижается от германия к свинцу: герман GeH4, станнан SnH4, плюмбан PbH4 представляют собой малоустойчивые и реакционноспособные газы, например,Герман воспламеняется на воздухе, а существование плюмбана маловроятно. По химическим свойствам эти соединения являются восстановителями. При хранении гидриды германия и олова постепенно разлагаются на свободный металл и водород.
Германий, олово и свинец находятся в земной коре в связанном виде; промышленно важными минералами являются касситерит SnO2 и галенит PbS (германий не имеет собственных минералов, он рассеян по различным полиметаллическим рудам).
Элементы VA-группы мышьяк As, сурьма Sb и висмут Bi имеют электронную конфигурацию валентного уровня атомов ns2np3. Они образуют соединения в степени окисления (+III) и (+V). Мышьяк и сурьма –амфотерные элементы, причём у мышьяка сильно преобладают неметаллические свойства, а у сурьмы – металлические, висмут проявляет металлические свойства.
Высшая степень окисления у висмута неустойчива и соединения висмута (V), например висмутат натрия, проявляют сильные окислительные свойства:
NaBiO3(т) + 6H+ + 2e = Bi3+ + Na+ + 3H2O.
В большинстве соединений элементов VA-группы связи ковалентные, даже в таких, как оксид-хлорид висмута Bi(Cl)O.
В свободном состоянии при нагревании вещества достаточно активны: реагируют с кислородом, галогенами, серой, а As также и с металлами, в кислотах не растворяются, только в кислотах-окислителях.
3As + 5HNO3(к) + 2H2O = 3H3AsO4 + 5NO
6Sb + 10HNO3(к) = 3Sb2O5 + 10NO +5H2O
Bi + 4HNO3(к)= Bi(NO3)3 + NO + 2H2O
В обычных условиях водородные соединения элементов AsH3(арсин) –SbH3(стибин) – BiH3(висмутин) – газообразные вещества с резким запахом и уже при небольшом нагревании разлагаются с образованием на стенках сосуда чёрного осадка с металлическим (простые вещества As, Sb, Bi). В ряду
AsH3 - SbH3 - BiH3 устойчивость падает, вследствие чего висмутин недостаточно изучен; по химическим свойствам они являются восстановителями.
Элементы подгруппы мышьяка образуют два ряда кислородных соединений – оксиды Э2О3 и Э2О5. Оксиды Э2О3 легко образуются при нагревании элементов на воздухе и представляют собой твёрдые вещества белого (As2O3 и Sb2O3) или желтоватого цвета (Bi2O3). Мышьяковистый ангидрид (As2O3) довольно хорошо растворим в воде, тогда как другие оксиды практически нерастворимы. Соответствующие им гидроксиды Э(ОН)3 афотерны, причём у As(OH)3 ярко выражен кислотный характер, у Sb(OH)3- основной, а у Bi(OH)3 кислотная функция выражена столь слабо, что обнаруживается лишь по незначительной растворимости этого гидроксида в растворах сильных щелочей. Одновременно с ослаблением кислотных и усилением основных свойств гидроксидов в ряду As(III)-Sb(III)-Bi(III) ослабляются также и восстановительные свойства.
Высшие оксиды – мышьяковый ангидрид (As2O5) и сурьмяный ангидрид (Sb2O5) могут быть получены при нагревании их гидратов, образующихся при окислении элементарных As и Sb концентрированной азотной кислотой. Мышьяковый ангидрид представляет собой белую стекловидную массу, расплывающуюся на воздухе. Желтоватый порошок сурьмяного ангидрида очень мало растворим в воде. Соответствующая As2O5 мышьяковая кислота (H3AsO4) легко растворима в воде и приблизительна равна по силе фосфорной. Для Sb2O5 определенные гидратные формы нехарактерны, и белый аморфный осадок xSb2O5∙yH2O в зависимости от условий выделения заметно меняет свой состав. В воде он почти нерастворим. Кислотные свойства сурьмяной кислоты выражены чрезвычайно слабо.
Окислительно-восстановительная активность элементов подгруппы мышьяка в характерных для них степенях окисления может быть выражена следующей схемой:
As3+ Sb3+ Bi3+ As5+ Sb5+ Bi5+



Элементы селен Se, теллур Te и полоний Po входят в состав VIA – группы Периодической системы. Электронная конфигурация валентного электронного уровня атомов этих элементов ns2np4. В соединениях для них характерны степени окисления (+IV) и (+VI), а также (-II). По электроотрицательности Se, Te, Po - амфотерные элементы с преобладанием неметаллических(Se и Te) или металлических свойств (Po). Cелен и теллур устойчивы на воздухе и нерастворимы в воде, все соединения селена ядовиты. Окислительная способность простых веществ от селена к полонию уменьшается.
Селен и теллур энергично взаимодействуют со фтором и хлором, при нагревании – с кислородом; со многими металлами при нагревании образуют селениды (K2Se) и теллуриды (K2Te), которые по своему характеру аналогичны сульфидам.
Теллур при обычных условиях очень медленно взаимодействует с водой по схеме:
Te + 2H2O = TeO2 + 2H2
При нагревании подобным образом реагирует и аморфный селен, в то время как кристаллический не взаимодействует с ней даже при 150°С.
Мелкораздробленные Se и Te растворяются в холодной концентрированной серной кислоте с образованием зеленой (Se) или красной (Te) жидкости. Растворение обусловлено взаимодействием:
Э + H2SO4 ↔ ЭSO3 + H2O
Так как реакция эта обратима, при разбавлении раствора водой происходит обратное выделение Se или Te.
Устойчивость водородных соединений падает в ряду H2Se > H2Te > H2Po. Восстановительные свойства возрастают от H2Se к H2Po (H2Te считается очень сильным восстановителем). В водном растворе H2Se и H2Te – слабые кислоты, кислотность этих соединений возрастает от селена к теллуру.
Кислородные соединения селена и теллура в степени окисления (+IV) проявляют в основном восстановительные свойства; они понижаются с ростом порядкового номера. Так из двух оксидов – SO2 и SeO2 – первый более сильный восстановитель, чем второй:
2SO2 + SeO2 = Se + 2SO3
Диоксиды селена и теллура – кислотные оксиды, в качестве гидроксидов им отвечают H2SeO3 и H2TeO3; в целом – это слабые кислоты в водном растворе.
Кислородные соединения селена и теллура в степени окисления (+VI) – оксиды SeO3, TeO3 и отвечающие им сильная кислота H2SeO4 и слабая кислота H6TeO6. Они проявляют окислительные свойства, причём самые сильные окислители – соединения селена. Так, концентрированная селеновая кислота окисляет хлорид-ион и золото:
H2SeO4(конц.) + 2HCl ↔ H2SeO3 + Cl2 + H2O
6H2SeO4 + 2Au = Au2(SeO4)3 + SeO2 + 6H2O
Равновесие первой реакции в кислой среде смещается вправо, в щелочной – влево.
Селен и теллур – редкие элементы, собственных минералов не образуют и содержатся в самородной сере и сульфидных рудах. Полоний – радиоактивный элемент, наиболее долгоживущий изотоп – 209Ро (период полураспада 102 года).
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 2757; Нарушение авторских прав?; Мы поможем в написании вашей работы!