КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Значение напряжения при электролитическом выделении металлов. Потенциал электрода. Поляризация и напряжение разложения
|
|
|
|
Прохождение тока через раствор электролита резко отличается от прохождения тока через металл. Если к концам металлического стержня присоединить провода от источника тока, то уже при самом небольшом приложенном напряжении через стержень будет идти поток электронов. Вещество металла при этом не изменяется, часть тока затрачивается только на некоторое нагревание проводника. Если же провода от источника постоянного тока опустить в раствор электролита, то электрический ток пойдет только при некоторых определенных условиях. Прохождение тока в этом случае связано с движением ионов в растворе и с разрядом ионов на электродах или с превращением атомов электрода в ионы. На электродах начинаются электрохимические процессы, которые приводят к изменению состава раствора и электрода. Таким образом, два одинаковых электрода становятся различными в результате прохождения тока через раствор. Эти два проводника становятся теперь различными полюсами гальванического элемента, возникающего внутри электролита; такое явление, препятствующее прохождению тока через раствор, называют поляризацией.
Так, при пропускании тока через раствор серной кислоты на отрицательном полюсе (платиновый электрод) выделяется водород, так как электроны, поступающие на платиновый катод, восстанавливают ионы водорода, превращая их в молекулы водорода:
2H+ + 2e- ↔ H2
На платиновом аноде, который отдает внешнему источнику тока электроны, выделяется кислород:
Н20 = 2H+ + 1/2 02 + 2е-.
Однако оба процесса обратимы. Поэтому выделившийся на катоде водород может снова восстанавливаться и переходить в раствор в виде ионов, отдавая электроны платиновому проводнику. Эти электроны по проводу поступают на другой электрод, содержащий кислород, и равновесие в последней реакции смещается влево.
Таким образом, при электролизе возникает гальванический элемент, ток которого направлен в сторону, обратную движению тока от внешнего источника. Поэтому ток от внешнего источника будет идти через электролит только в том случае, если приложенное напряжение будет достаточно для определенного химического процесса, а именно для электролиза раствора или для образования ионов из материала электрода. Необходимое для этой цели напряжение называют напряжением разложения, оно зависит, прежде всего, от состава раствора.
Пусть, например, в качестве электролита взяты растворы сульфатов или нитратов серебра, меди, свинца и цинка, причем каждый раствор содержит 1 М ионов металла в 1 л. При электролизе таких растворов на платиновом аноде всегда идет один и тот же процесс - выделение кислорода. На платиновом катоде происходит восстановление ионов того или иного металла. Из названных четырех ионов ионы серебра восстанавливаются легче всего, поэтому для электролиза раствора нитрата серебра достаточно приложить сравнительно небольшое напряжение - приблизительно 0.9 В. Ионы меди восстанавливаются труднее, чем ионы серебра, поэтому электролиз раствора сульфата меди будет идти только при значительно большем напряжении, а именно около 1.4 В. Ионы свинца и цинка восстанавливаются еще труднее, и для электролитического разложения растворов солей свинца и цинка необходимо приложить к электродам дополнительное напряжение (не менее 1.9 и 2.5 В, соответственно).
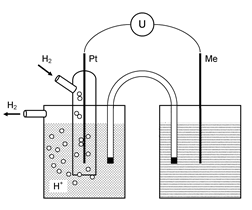
Напряжение, необходимое для электролиза 1 М растворов хорошо диссоциированных солей, можно найти из ряда напряжений. Падение напряжения в растворе характеризуется главным образом двумя скачками потенциала: на аноде и катоде. Для измерения этих скачков потенциала в качестве стандартного («нулевого») электрода сравнения применяют водородный электрод. Этот электрод (рис. 5.1) состоит из платиновой проволоки, помещенной в стеклянную трубку. Платиновая проволока внизу покрыта губчатой платиной. Часть губчатой платины находится в атмосфере водорода, другая часть погружена в 1 М раствор серной кислоты. Для измерения скачков потенциала между различными электродами и растворами водородный электрод 1 соединяют с испытуемым электродом в гальванический элемент (рис. 5.2). Напряжение испытуемого электрода измеряют вольтметром (потенциометром). Оба электрода (испытуемый и водородный) соединяют в гальванический элемент с помощью пористой перегородки или сифоном (электролитический ключ), наполненным каким-либо нейтральным электролитом (КСl, NaNO3) и снабженным «пробками» из фильтровальной бумаги.

| 
|
| Рис. 5.1. Схема водородного электрода | Рис. 5.2. Схема для измерения потенциала металлического электрода: 1 - водородный электрод; 2 - испытуемый электрод; 3 - потенциометр; 4-электролитический ключ; 5 - «пробки» из фильтровальной бумаги |
С помощью описанной выше схемы возможно определить знак испытуемого электрода (положительный или отрицательный) и численное значение его потенциала по сравнению с потенциалом водородного электрода. Потенциал водородного электрода принят равным нулю, поэтому измеренное напряжение характеризует скачок потенциала между испытуемым металлическим электродом и раствором соответствующей соли. В результате таких измерений составлен ряд напряжений.
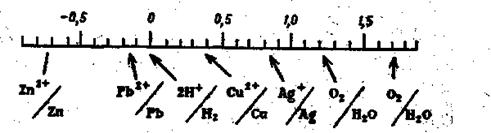
На рис. 5.3 графически показано место потенциалов некоторых электродов в ряду напряжений. Численные значения относятся к активности соответствующего иона в растворе, равной единице. Такие потенциалы называют стандартными потенциалами. Ряд напряжений имеет большое значение для всех электрохимических методов анализа. В электроанализе ряд напряжений позволяет вычислить напряжение разложения электролита.
Пользуясь рядом напряжений, можно рассчитать напряжение гальванического элемента, составленного из той или иной пары электродов. Так, гальванический элемент, составленный из водородного электрода и подобного же по конструкции кислородного электрода (при условии работы с губчатой платиной), может дать напряжение 1,23 В (рис. 5.3).
| |||
| Рис.5.3. Ряд напряжений металлов |
Кроме того, если в 1 М раствор H2SO4 пропускать ток через платиновые, покрытые губчатой платиной электроды, на катоде выделяется водород, а на аноде – кислород. Таким образом, в результате пропускания тока образуется гальванический элемент, который может давать ток с напряжением 1.23 В, направленный против тока внешнего источника напряжения. Очевидно, ток сможет идти через раствор только в том случае, если приложенное напряжение будет не менее 1.23 В.
Если при пропускании тока в качестве анода взять не губчатую платину, а обычную гладкую платину, то выделение кислорода значительно затрудняется и для электролиза необходимо большее напряжение, а именно: 1.7 В (рис. 5.3). Подобным же образом из ряда напряжений можно найти значение напряжения разложения для растворов электролитов, если известны процессы, идущие на катоде и аноде. Так, раствор, в
1 л которого содержится 1 моль ионов серебра и 1 моль ионов водорода, при электролизе образует гальванический элемент с кислородным и серебряным электродами. Напряжение такого гальванического элемента, в соответствии с данными рис. 5.3, будет составлять: 1.7 – 0.8 = 0.9 В. Аналогично рассчитывают из данных рис. 3 напряжение разложения для раствора сульфата меди:1.7- 0.34=1.36 В и т. д.
Из приведенных примеров видно, что напряжение разложения представляет собой алгебраическую разность потенциалов анода и катода и в общем случае может быть вычислено без учета перенапряжения по уравнению:
Ер = Еа - Ек, (5.6)
где Ер - напряжение разложения, Eа и Ек - соответственно величины потенциалов анода и катода.
Для выделения пузырьков водорода на чистом цинковом катоде необходимо перенапряжение 0.70 В, а для выделения на гладкой поверхности ртути - 0.76 В.
Перенапряжение зависит от ряда факторов. Прежде всего, имеет значение материал электрода. Так перенапряжение выделения водорода на ртутном катоде значительно больше, чем на электродах из других металлов. Перенапряжение, как правило, возрастает с увеличением плотности тока и зависит также от температуры раствора.
Перенапряжение необходимо иметь в виду при вычислении напряжения разложения при выделении металлов. Явление перенапряжения дает возможность выделять ряд электроотрицательных металлов из водных растворов их солей. Если бы не было явления перенапряжения, то при электролизе растворов солей цинка или свинца вместо металлического цинка или свинца должен был бы выделяться только водород (рис. 5.3).
Влияние концентрации. Потенциал электрода зависит не только от природы данных веществ, но и от концентрации ионов в растворе. Выше был рассмотрен пример электролиза 1М раствора нитрата серебра; для выделения серебра из такого раствора необходимо приложить напряжение 0.9 В. Очевидно, если концентрация серебра в растворе меньше 1 М, восстановление будет идти труднее и придется приложить большее напряжение. Серебряный электрод погружен в разбавленный (например, 0,1 или 0.01) раствор соли серебра, имеет по отношению к водородному электроду потенциал меньший, чем 0.9 В. Это соответствует увеличению напряжения разложения, так как потенциал выделения металла сдвигается влево,
т. е. дальше от потенциала выделения кислорода (рис.5. 3).
Зависимость потенциала металлического электрода от концентрации ионов этого металла в растворе выражается уравнением Нернста:
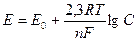 , (5.7)
, (5.7)
где Е - потенциал при данных температуре и концентрации; Е0 - стандартный потенциал (значение его может быть взято из ряда напряжений); R - газовая постоянная (8.313 Дж); T - абсолютная температура; n - число электронов, принимающих участие в электрохимической реакции; F - число Фарадея (≈96500 Кл); С - концентрация ионов металла в растворе.
Пусть, например, необходимо вычислить потенциал серебряного электрода, погруженного в раствор, содержащий 10-6 М серебра в 1 л.
По уравнению Нернста находим:
E = 0.8 + (2.3 (8.313∙293)/ 1∙96500)∙lg10-6 = 0.8 – 0.058 ∙ 6 = 0.45 В.
Полученный результат дает возможность вычислить напряжение разложения, необходимое для практически полного выделения серебра, т. е. для того, чтобы в растворе оставалось 10-6 М ионов серебра в 1 л.
Обычно применяют гладкий платиновый анод, на котором выделяется кислород; раствор, к концу электролиза, бывает кислым. Потенциал кислородного электрода при этих условиях можно принять равным 1.7 В. Отсюда необходимое напряжение разложения (EР) очевидно составляет:
Eр = Еа - Ек = 1.7 – 0.45 = 1.25 В.
ФИЗИЧЕСКИЕ УСЛОВИЯ ОСАЖДЕНИЯ МЕТАЛЛОВ
Влияние напряжения. Напряжение влияет на все характеристики осадка. Если к электродам приложить недостаточное напряжение, металл не будет выделяться вообще или выделение его будет неполным.
Если приложить слишком большое напряжение, то, кроме интересующего нас металла, на электроде могут выделяться другие присутствующие в растворе металлы, т. е. получится загрязненный осадок. Кроме того, при слишком большом напряжении нередко образуется рыхлый, губчатый осадок металлов. Таким образом, электролитическое осаждение металлов необходимо вести в определенном интервале напряжения тока.
В зависимости от химических условий этот допустимый интервал может быть более или менее узким. В большинстве случаев для электролитического осаждения выбирают такие химические условия, при которых нет необходимости строго регулировать напряжение. Тем не менее, обычно во всех установках для проведения электрогравиметрического анализа предусмотрена возможность регулирования напряжения.
Наиболее простая схема для электроанализа показана на рис.5. 4.
Движением ползунка 4 на реостате 3 можно изменять общее сопротивление цепи и таким образом регулировать напряжение на клеммах электролизера 6.

Рис. 5.4. Схема прибора для электроанализа: 7 - источник постоянного тока; 2-вольтметр; 3 - реостат; 4 - ползунок реостата; 5 - амперметр; 6 - электролизер
Сила тока I в цепи зависит по закону Ома от напряжения Е, приложенного к электродам, напряжения разложения Eр электролита в электролизере и от общего сопротивления цепи R:
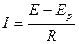 . (5.8)
. (5.8)
Обычно сопротивление цепи R состоит из двух частей: сопротивления реостата и омического сопротивления раствора.
Из рассмотренных выше особенностей прохождения тока через электролит, а также из приведенной формулы видно, что ток будет идти в том случае, если приложенное напряжение выше, чем напряжение разложения, т. е. если Е > Eр. Избыток напряжения, т. е. Е - Ер, распределяется между отдельными участками цепи пропорционально их сопротивлению.
Пусть, например, напряжение источника тока равно 6 В, напряжение разложения раствора в электролизере составляет 2 В, сопротивление реостата равно 30 Ом и омическое сопротивление раствора 10 Ом. Из общего напряжения 6 В на преодоление напряжения гальванического элемента будет затрачено 2 В, образующегося в электролизере. Остаток (4 В) распределится между клеммами реостата и раствором. Отношение омического сопротивления реостата и раствора равно, согласно условию, 30:10. Следовательно, избыток напряжения 4 В распределится также в отношении 3:1, т. е. 3 В пойдет на преодоление сопротивления реостата и 1 В на преодоление омического сопротивления раствора.
Вольтметр, включенный на клеммы электролизера, покажет отклонение, соответствующее 3 В, из которых 2 В соответствуют напряжению разложения и 1 В - преодолению омического сопротивления раствора.
Из рассмотренного примера видно, что показания вольтметра зависят не только от напряжения разложения, но также от омического сопротивления раствора. Омическое же сопротивление электролизера зависит от расстояния между электродами, температуры и концентрации электролита. Последние два фактора обычно изменяются во время электролиза.
Таким образом, перед выполнением анализа точно рассчитать необходимое напряжение нельзя. Наконец, напряжение разложения зависит также от того, осаждается ли металл из растворов простой, хорошо диссоциированной соли или из раствора комплексной соли.
Все рассмотренные явления приводят к тому, что при электрогравиметрическом анализе очень редко применяют методы, в которых для осаждения металла требуется точно определенное напряжение. Необходимый минимум напряжения можно рассчитать на основании рассмотренного выше понятия о ряде напряжений с учетом уравнения Нернста.
Если нужно выделить металл из такого раствора, в котором нет других катионов, то очевидно целесообразно повышать напряжение, так как это будет способствовать более полному и быстрому выделению. Верхний предел напряжения обусловливается в этом случае только побочными причинами: нагреванием раствора, выделением рыхлого осадка металла и т. д.
При необходимости разделения металлов иногда приходится ограничивать напряжение. При этом очевидно напряжение целесообразно повышать только до тех пор, пока еще не будет превышено напряжение разложения для раствора соли второго металла. Например, для разделения серебра и меди в растворе их сульфатов, следует применять напряжение не выше 1.4 В. Это значение соответствует напряжению разложения 1 М раствора сульфата меди, между тем как в условиях анализа концентрация ионов меди обычно значительно ниже. Следовательно, при напряжении менее 1.4 В (например, при использовании железо-никелевого аккумулятора) на электроде будет осаждаться только серебро.
Легко видеть, что при количественном осаждении серебра, т. е. когда его концентрация в растворе станет равной 10-6M, потенциал катода достигает значения
Ех = 0.8 + 0.06 lg10-6 = 0.44 В,
и, следовательно, уже при напряжении 1.7 – 0.44 = 1.26 В осаждение серебра должно быть практически полным.
Влияние силы и плотности тока. Для полного осаждения 1 моль эквивалента металла необходимо пропустить через раствор 96500 Кл (число Фарадея), если даже при электролизе не будут протекать побочные процессы.
Для определения берут обычно 0.01-0.02 эквивалента металла, например 0.3-0.6 г меди. При силе тока 1 А для осаждения этого количества металла достаточно 15-30 мин. В действительности приходится пропускать значительно большее количество электричества, чем рассчитанное по числу Фарадея, так как на катоде протекают побочные процессы (выделение водорода, восстановление ионов  и т. п.). Затрата количества электричества на побочные процессы часто уменьшается при перемешивании раствора, т. е. при быстром подводе ионов осаждаемого металла к поверхности катода. Во всех случаях перед окончанием электролиза необходимо проверить полноту осаждения. Для этого, например, платиновый катод погружают несколько глубже в раствор, пропускают электрический ток и наблюдают за выделением металла. Если свежая поверхность электрода не покрывается выделяемым металлом, то это означает, что металл выделился полностью и электролиз можно прекращать.
и т. п.). Затрата количества электричества на побочные процессы часто уменьшается при перемешивании раствора, т. е. при быстром подводе ионов осаждаемого металла к поверхности катода. Во всех случаях перед окончанием электролиза необходимо проверить полноту осаждения. Для этого, например, платиновый катод погружают несколько глубже в раствор, пропускают электрический ток и наблюдают за выделением металла. Если свежая поверхность электрода не покрывается выделяемым металлом, то это означает, что металл выделился полностью и электролиз можно прекращать.
Сила тока влияет на характер образующегося осадка металла. Имеет значение не количество электричества, а плотность тока на катоде, т. е. количество ампер на единицу поверхности катода. При очень малых плотностях тока металл иногда осаждается в виде крупных кристаллов, которые растут отдельными ветвями. Такие ветви металла легко обрываются, когда электрод вынимают из раствора. При очень большой плотности тока может образоваться рыхлый, губчатый осадок металла, так как происходит быстрое осаждение металла и в слое раствора вблизи электрода резко уменьшается концентрация ионов металла. В результате нередко начинается выделение водорода и происходит ряд других явлений, ведущих к разрыхлению осадка металла. Губчатый осадок легко осыпается с электрода, сильно окисляется при высушивании, поэтому очень неудобен в работе.
В некотором среднем интервале плотности тока получается плотный осадок, хорошо пристающий к поверхности электрода. Такой осадок легко промывается, не окисляется при высушивании и, следовательно, наиболее удобен в работе. Плотный осадок получается обычно при плотности тока 1-3 А на 100 см2 поверхности электрода. В зависимости от химических условий осаждения эти значения могут изменяться, а иногда, например, при осаждении серебра из раствора AgNO3, очень трудно вообще получить плотный осадок.
ХИМИЧЕСКИЕ УСЛОВИЯ ОСАЖДЕНИЯ МЕТАЛЛОВ
Значение химических условий при электрогравиметрическом анализе частично отмечалось выше. Кислотность раствора, присутствие анионов азотной или серной кислоты, введение анионов, образующих с металлами комплексы - все это имеет очень большое значение при электролитическом выделении металлов. Обычно химические условия еще в большей мере, чем физические, определяют полноту осаждения, чистоту осадка и его внешние качества.
Рассмотрим метод электролитического разделения меди и цинка.
Медь и цинк занимают различные места в ряду напряжений (рис.5.3). Для разделения таких металлов можно ограничиться определенными физическими условиями, а именно: приложить к электродам напряжение, достаточное для количественного осаждения меди, но недостаточное для выделения цинка даже из концентрированных растворов его солей. Для электролиза 1 М раствора сульфата цинка необходимо напряжение E = 1.7 - (-0.8) = 2.5 В. Если приложить меньшее напряжение, например 1.7 В, цинк выделяться не будет. Полноту выделения меди в этих условиях можно вычислить из уравнения Нернста. Напряжение разложения 1.7 В при выделении на аноде кислорода в ряду напряжений соответствует потенциалу на катоде, равному нулю, т. е, потенциалу стандартного водородного электрода. Подставляя это значение в уравнение Нернста, находим:
 .
.
Отсюда рассчитываем концентрацию ионов меди, которые могут остаться в растворе при данном катодном потенциале:
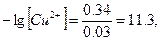
откуда
[Cu2+] = 10-11.3 = 5∙10-12 M.
Следовательно, в этих условиях осаждение ионов меди будет практически полным.
Рассмотренный пример показывает, что разделение меди и цинка вполне возможно. Однако необходимоcть ограничения напряжения тока вызывает большие неудобства. В этом случае ток идет главным образом только за счет переноса ионов меди, поэтому по мере осаждения ионов меди сила тока уменьшается и осаждение замедляется.
Значительно удобнее для разделения меди и цинка создавать определенные химические условия. Для этого достаточно просто подкислить раствор азотной кислотой. Ионы  являются в данном случае «буферными» ионами:
являются в данном случае «буферными» ионами:
 + 10Н + + 8e- =
+ 10Н + + 8e- =  + 3H2O.
+ 3H2O.
После выделения меди напряжение на электродах повышается, однако это приводит к восстановлению ионов  , а ионы цинка не восстанавливаются. Таким образом, нет необходимости во время электролиза постоянно следить за напряжением тока.
, а ионы цинка не восстанавливаются. Таким образом, нет необходимости во время электролиза постоянно следить за напряжением тока.
Условия разделения металлов сильно зависят от кислотности раствора. Большое значение имеет характер присутствующих анионов. Характер электролитических осадков металлов обусловлен присутствием ионов, образующих комплексы с ионами металлов. Из растворов комплексных солей обычно получаются более плотные осадки даже при больших плотностях тока.
ВЫХОД ПО ТОКУ
Законы Фарадея соблюдаются во всех случаях и при любых условиях ведения электролиза. Если вещество выделится в количестве меньшем, чем то, которое может быть найдено по расчету в соответствии со временем электролиза и силой тока, это может означать, что затрачиваемое количество электричества используется непроизводительно. Наряду с выделением данного вещества может иметь место и побочный процесс.
Например, при электролитическом получении металлов из водных растворов, побочным процессом будет являться выделение водорода. Количество выделяющегося вещества может быть значительно снижено, или даже сведено к нулю, если не воспрепятствовать там, где это необходимо, обратному воссоединению катодных и анодных продуктов в исходное вещество. Это может иметь место, например, при получении металлов электролизом их расплавленных хлоридов. В этом случае применяют электролизеры специального устройства, обеспечивающие надежную защиту полученного металла от выделяющегося на аноде хлора.
Для оценки эффективности использования электричества на выделение того продукта, ради получения которого ведется электролиз, применяют понятие выхода по току.
Выход по току (ВПТ) может быть определен как отношение количества вещества, фактически полученного при электролизе g, к тому его количеству g0, которое должно быть получено по расчету, в соответствии с прошедшим количеством электричества:
ВПТ= (g/ g0)∙100%. (5.9)
Если обозначить через q0 количество электричества, которое потребуется для электрохимического выделения данного количества вещества по теоретическому расчету, а через q - количество электричества, израсходованное в действительности, то выход по току может быть также определен из следующего соотношения:
ВПТ = (q / q0)∙ 100%. (5.10)
Так как электроаналитическое определение производится по оценке привеса электрода, на котором выделяется данное вещество, то следует обеспечить такие условия, чтобы только это вещество (данный металл) осаждалось на электроде. Следовательно, для электролиза, производимого в аналитических целях, желательно обеспечить стопроцентный выход по току.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 5022; Нарушение авторских прав?; Мы поможем в написании вашей работы!