
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач
|
|
|
|
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пример 1. Навеску цветного сплава массой 1.525 г растворили и путем электролиза при постоянной силе тока 0.2 А за 45 мин выделили на катоде медь и на аноде свинец в виде PbO2. Определите массовую долю (%) меди и свинца в сплаве, если выход по току 100%.
Решение.
 .
.
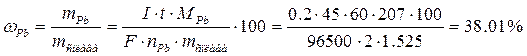 .
.
Пример 2. При электролизе металлический шар радиусом 4 мм, помещенный в водный раствор хлорида золота (III) с концентрацией 0.1 М, покрывается слоем золота. Определите толщину пленки золота, если время пропускания тока силой 204 мА составляет 2 часа, а плотность золота равна 19320 кг/м3. Составьте уравнения электродных процессов.
Решение.
Составим уравнение электродных процессов. В водном растворе под действием полярных молекул растворителя протекает процесс диссоциации хлорида золота AuCl3 по схеме:
AuCl3 «Au3+ + 3Cl-.
Кроме того, вода является слабым электролитом и ее молекулы диссоциируют на катионы водорода и анионы гидроксогрупп:
H2O «H+ + OH-.
Следовательно, в водном растворе хлорида золота присутствуют 2 вида катионов (Au3+ и H+) и 2 вида анионов (Cl– и OH–). Катионы золота и водорода способны восстанавливаться на катоде по следующим схемам:
Au3+ + 3е- ® Au,
2H+ + 2е- ® H2.
Возможные анодные процессы окисления:
4OH- – 4е- ® О2 + 2Н2O,
2Cl- – 2е- ® Cl2.
Какие именно электрохимические процессы будут протекать у электродов при электролизе, прежде всего, зависит от относительных значений электродных потенциалов соответствующих электрохимических систем.
Из нескольких возможных процессов будет протекать тот процесс, осуществление которого сопряжено с минимальной затратой энергии. Это означает, что на катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал, а на аноде будут окисляться восстановленные формы систем с наименьшим электродным потенциалом.
Воспользуемся уравнением Нернста и определим электродные потенциалы возможных процессов окисления и восстановления:

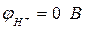 .
.
Так как jAu3+ > jH+, следовательно, на катоде будут восстанавливаться катионы золота Au3+, т.е. на катоде протекает процесс:
(К): Au3+ + 3е- ® Au.
Так как
 ,
,
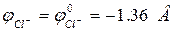 ,
,
т.е. jOH– > jCl–, следовательно на катоде будут окисляться анионы гидроксогрупп OH–, на аноде протекает процесс:
(А): 4OH- – 4е- ® О2 + 2Н2O
За время электролиза t масса золота m, осаждающегося на поверхность шара радиуса r, определяется законом Фарадея:

Подставив данные из условия задачи, определим численное значение массы золотой пленки:

Масса осажденного золота связана с плотностью золотого покрытия r и объемом пленки V Au соотношением: m = r×VAu, из которого определим объем осажденной пленки:
 см3.
см3.
Таким образом, первоначальный объем шара V0 = 4p/3×r3 в процессе электролиза увеличился (схематично данный процесс изображен на рис.5.5) и составляет:
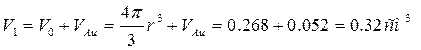 .
.

Рис.5.5. Схема шара с осажденным на его поверхности золотом
Воспользуемся выражением для объема шара радиуса R = r + d:
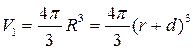 .
.
Из последнего соотношения найдем толщину слоя золота d:
 .
.
Ответ: Толщина пленки золота, осажденного в процессе электролиза, составляет 0.024 см. В ходе электролиза на электродах протекают следующие процессы:
(К): Au3+ + 3е- ® Au
(А): 4OH- – 4е- ® О2 + 2Н2O
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 2709; Нарушение авторских прав?; Мы поможем в написании вашей работы!