
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Простые белки
|
|
|
|
Классификация белков
Методы фракционирования (разделения) белков
Экстракция (извлечение) белков
Методы гомогенизации
Для выделения индивидуального белка из биологического объекта используют различные способы гомогенизации (измельчения) тканей вплоть до разрушения клеточных стенок.
С этой целью используют специальные приборы – гомогенизаторы и другие методы:
– валковые или шаровые мельницы, в которых исследуемый материал многократно продавливается между тесно сближенными вальцами (рис. 10, а);
– гомогенизаторы, в которых материал либо измельчается острыми ножами, вращающимися с огромной скоростью (1200 об/мин), либо растирается между пришлифованными стенками стеклянной пробирки (гомогенизатора) и пестика (рис. 10, б, в, г)
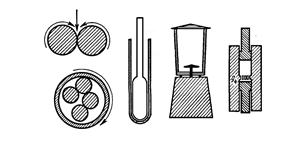
а б в г
Рис. 10. Приборы, используемые для гомогенизации тканей при выделении белков
– для разрушения клеточных мембран используют метод попеременного оттаивания и замораживания. Образующиеся во время заморозки кристаллы льда разрывают стенки клеток и освобождают клеточное содержимое.
– применяют метод «азотной бомбы». Суть его заключается в насыщении суспендированных клеток (жидким) газообразным азотом под высоким давлением. После сбрасывания давления азот, проникший внутрь клеток, выделяется в виде газа и «взрывает» клетки.
Измельчение биоматериала, как правило, проводят одновременно с экстракцией. Преимущественно для извлечения белков используют 8–10% растворы нейтральных солей. Большая часть белков хорошо растворяется в таких солевых растворах.
Поскольку на растворение белков сильное влияние оказывает рН среды, большинство солей применяют в виде буферных смесей (фосфатных, ацетатных, боратных, цитратных и т.п.). Широко используют буферные смеси, составленные с применением органических соединений:
– трис-(оксиметил)-аминометан – (НОСН2)3CNH2 и его соль с соляной кислотой (трис-буфер); 
– диэтилбарбитуровая кислота и ее натриевая соль (веронал-мединаловый буфер)
– N,N-бис(2-оксиэтил)-глицин – (НО-СН2-СН2)2NСН2СООН (бициновый буфер)
Применяемый при экстракции глицерин предохраняет белки от денатурации.
Извлечению белков из биологического материала и белково-липидных комплексов биомембран способствует обработка их детергентами – додецил сульфат натрия, тритон-Х-100 и дезоксихолат натрия (рис. 11).
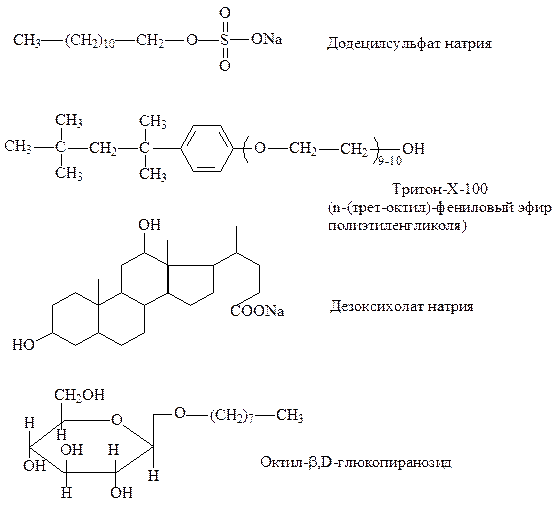 |
Рис. 11. Детергенты, используемые для экстракции белков
Детергенты ослабляют гидрофобные белок-липидные и белок-белковые взаимодействия. В результате происходит деструкция биологических мембран и высвобождение из них структурных и функциональных белковых компонентов, например, ферментов.
Перечисленные выше методы выделения и экстракции белков применяются в основном при исследовании животных тканей.
Выделение белков из растительного сырья осуществить труднее. Это связано со строением растительной клетки. Клеточная стенка у растений многослойная и очень прочная, разрушить ее сложно, поэтому при гомогенизации высока вероятность денатурации белка.
В связи с этим, при выделении белков из вегетативных органов растений используют специфические приемы – обработку тканей водно-эфирной смесью, резко повышающей проницаемость оболочки растительной клетки (метод Чибнелла), экстракцию белков смесью фенола, уксусной кислоты и воды (метод Синджа) и др.
После экстракции смеси белков из биологического материала проводят ее разделение на индивидуальные фракции белков. Разработано несколько методов фракционирования белков, основанных на различных физико-химических свойствах белков.
– осаждение белков в изоэлектрической точке – в основе метода лежит свойство белков в изоэлектрической точке выпадать в осадок вследствие нейтрализации заряда белковой молекулы. Для каждого белка значение изоэлектрической точки строго индивидуально, поэтому данным методом возможно выделение индивидуальных белков (подробнее о методе см. лабораторную работу №3 в курсе «Биохимия»).
– фракционирование белков методом высаливания – основано на различной растворимости белков в концентрированных растворах нейтральных солей, в зависимости от молекулярной массы (подробнее о методе см. лабораторную работу №3 в курсе «Биохимия»).
– метод электрофоретического разделения белков на фракции – описан в разделе физико-химические свойства белков.
Кроме представленных выше методов для разделения белков на фракции широко используют хроматографические методы. Чаще всего используют колоночную хроматографию.
Особенностью данного метода является то, что смесь молекул различных белков и пептидов пропускают через колонку, содержащую твердый пористый материал (матрикс). В результате взаимодействия с матриксом различные белки проходят через колонку с различной скоростью. После того как белки достигнут в определенной последовательности дна колонки, их собирают отдельными фракциями в пробирки.
Выделяют три основных вида колоночной хроматографии:
– ионообменная – для хроматографии белков применяют ионообменники на основе целлюлозы или других гидрофильных полимеров, например, диэтиламиноэтилцеллюлозу (ДЭАЭ-целлюлоза), содержащую катионные группы (отрицательный заряд) или содержащую карбоксиметилцеллюлозу (КМ-целлюлоза), содержащую аминные группы (положительный заряд):
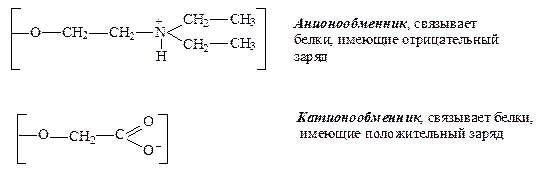
Прочность связывания белков с ДЭАЭ-целлюлозой тем выше, чем больше в молекуле белка карбоксильных групп. Белки, адсорбированные на ДЭАЭ-целлюлозе, можно смыть (элюировать) из колонки растворами с возрастающей концентрацией хлорида натрия. Вначале элюируются слабосвязанные белки, а по мере увеличения концентрации соли и другие белки, в порядке возрастания их сродства к ДЭАЭ-целлюлозе.
Аналогично применяют и КМ-целлюлозу, но сродство белков к ней прямо пропорционально числу аминогрупп в молекуле белка.
Для снятия связанного белка также изменяют рН элюента.
– хроматография гель-фильтрацией – имеет второе название «метод молекулярных сит». В качестве сит используют сефадекс (полисахарид декстран, обработанный эпихлоридгидрином). Зерна сефадекса набухают в воде и образуют гель. Набухшие гранулы имеют поры определенного диаметра.
Разделение основано на том, что зерна сефадекса (поры гранул) непроницаемы или ограничено проницаемы для веществ с большой молекулярной массой, а небольшие молекулы свободно диффундируют (проникают) в поры зерен.
Гелеобразную массу набухшего сефадекса помещают в стеклянную колонку (трубку), на поверхности геля наносят слой белкового раствора (рис. 12, а) и затем через колонку пропускают буферный раствор (элюирующая жидкость). Белки проходят вдоль колонки между гранулами тем медленнее, чем меньше их молекулярная масса, так как молекулы белков с еще меньшей молекулярной массой легче диффундируют внутрь гранул (в поры) (рис. 12).
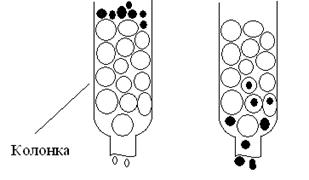
Рис. 12. Фракционирование белков методом гель-фильтрации
Белки вымываются (элюируются) из колонки в порядке убывания молекулярной массы. Следовательно, первыми элюируются крупные белковые молекулы (рис. 12, б), которые не диффундируют в зерна, затем мелкие молекулы и в последнюю очередь низкомолекулярные примеси.
Этот метод применяют не только для фракционирования белков по молекулярной массе, но и для очистки их от низкомолекулярных примесей.
– аффинная хроматография – или хроматография по сродству. Принцип метода заключается в том, что происходит избирательное взаимодействие белков со специфическими веществами – лигандами, закрепленными на носителях (рис. 13).
В качестве носителя используют активированную бромцианом сефарозу. К сефарозе присоединяют лиганды различного происхождения – субстрат, или антиген, или рецептор, которые будут афинно связывать только один белок из смеси:
– субстрат → фермент;
– антиген → антитело;
– гормон → рецептор данного гормона.
Другие белки, не связавшиеся с лигандом, удаляются путем промывания колонки.
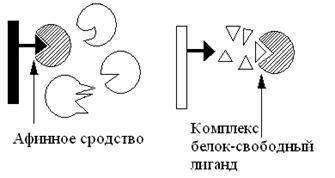
Рис. 13. Механизм аффинной хроматографии
Снятие с колонки афинно закрепленного белка осуществляется с помощью буферного раствора (элюента). В состав буфера вводят детергент, который ослабляет связи между белком и лигандом, или через колонку пропускают раствор с высокой концентрацией свободного лиганда. В этом случае белок легче связывается со свободным лигандом и вымывается (элюируется) из колонки.
В основе классификации лежат:
1. Физико-химические факторы: кислые, основные и нейтральные белки, а также гидрофильные, гидрофобные и амфифильные.
2. Функциональные свойства
В основе лежат биологические свойства белков – каталитические, защитные, транспортные, регуляторные, механические, сократительные и др.
3. С труктурные признаки:
а) простые белки – протеины, представлены только полипептидной цепью;
б) сложные белки – протеиды – в основе классификации лежит характер простетической группы (небелковая часть):
– гликопротеины (небелковая часть представлена углеводами);
– липопротеины (небелковая часть представлена липидами);
– нуклеопротеины (небелковая часть представлена нуклеиновыми кислотами);
– витаминпротеины (небелковая часть представлена витаминами);
– хромопротеины (небелковая часть представлена окрашенными соединениями, например, гем гемоглобина);
– металлопротеины (небелковая часть представлена металлами);
– фосфопротеины (небелковая часть представлена остатками фосфорной кислоты, например, в казеине молока).
К этой группе белков относят гистоны, протамины, альбумины, глобулины, проламины, глютелины и протеиноиды (α-кератин, фиброин, коллаген, эластин).
Гистоны – тканевые белки многоклеточных организмов, локализованы в ядре клеток. Представляют собой низкомолекулярные (Мм 11000–24000) белки с третичной структурой, обладают выраженными основными свойствами (рI 9,5–12), т.к. содержат большое количество аргинина и лизина.
Гистоны прочно связаны с ДНК хроматина (связь ионная). Выделяют пять фракций гистонов (методом электрофореза в полиакриламидном геле, ПААГ). Разделение на фракции зависит от соотношения в них аргинина и лизина.
Основные функции гистонов – структурная и регуляторная:
– структурная – гистоны участвуют в стабилизации пространственной структуры ДНК, а следовательно хроматина, хромосом и нуклеосом;
– регуляторная – заключается в способности блокировать передачу генетической информации от ДНК к РНК (транскрипцию) (рис. 14).
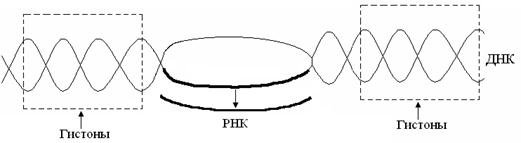
Рис. 14. Транскрипция ДНК
Участки ДНК, связанные с гистонами, не могут подвергаться транскрипции. Там, где ДНК свободна от гистонов, двойная спираль расплетается и освободившийся участок ДНК подвергается транскрипции.
Протамины – самые низкомолекулярные белки (Мм 4000–12000). Резко выражен основный характер, так как содержат до 80% аргинина. Протамины связывают ДНК в хроматине спермиев и делают ее компактной. Выполняют главным образом структурную функцию, поэтому и присутствуют в клетках не способных к делению.
Альбумины и глобулины – содержатся в плазме крови, в клетках тканей, молоке, клетках растений, зерне и др. Они разнообразны по структуре, физико-химическим свойствам и биологической роли.
Альбумины – белки с Мм 15000–70000, следовательно, это мелкодисперсные белки. Имеют выраженный кислый характер (рI 4,7) так как содержат большое количество аспарагиновой и глутаминовой кислот. Хорошо растворимы в воде.
Биологические функции альбуминов:
1. Трофическая (питательная) – альбумин куриного яйца (овальбумин), молока (лактальбумин), зерновых культур и другие.
2. Транспортная – альбумины обладают высокой адсорбционной способностью (адсорбируют полярные и неполярные молекулы). Например, альбумины крови транспортируют жирные кислоты от жирового депо к другим органам и тканям.
3. Обезвреживающая – альбумины связывают токсичные соединения – алкалоиды, тяжелые металлы, билирубин.
4. Альбумины обеспечивают на 80% осмотическое давление крови от всех других сывороточных белков.
Глобулины – это слабокислые или нейтральные белки (рI 6,0–7,3), Мм >100000. Они нерастворимы в воде, но растворяются в слабо-солевых растворах нейтральных солей (например, 0,9% NaCl), поэтому мало гидратированы.
Глобулины являются неоднородными белками. При электрофорезе на хроматографической бумаге их можно разделить в зависимости от электрофоретической подвижности на 4 фракции: α1-, α2-, β-, γ-глобулины.
Биологические функции глобулинов:
1. Транспортная – в крови глобулины транспортируют холестерин, фосфолипиды, триглицериды, гаптоглобин, церулоплазмин, трансферрин, ионы железа (Fe2+), меди (Cu2+), витамин В12. В молоке лактоглобулины и лактальбумины также выполняют транспортную функцию.
2. Гемостатическая – β-глобулины содержат протромбин (свертывающая система)
3. Защитная – фракция γ-глобулинов представлена смесью различных иммуноглобулинов. α1-глобулины транспортируют острофазовый белок α1-кислый гликопротеин.
4. Трофическая – глобулины составляют основную часть запасных белков семядолей бобовых культур (сои, гороха, фасоли, вики), алейроновых зерен масличных культур (подсолнечника, хлопчатника, льна, горчицы) и овощных культур.
5. Альбумины и глобулины зародыша и алейронового слоя выполняют каталитическую (ферментативную) функцию при прорастании зерна и в технологических процессах.
Проламины – белки растительного происхождения, содержатся в клейковине семян злаковых растений. В их состав входит большое количество глутамина (14–43%), пролина (6,3–19,0%) и малое количество ионогенных групп (дикарбоновые аминокислоты почти полностью амидированы, RCONH2). Проламины отличаются низким содержанием лизина. Очень мало его в зеине кукурузы (0,2%), глиадине пшеницы и секалине ржи (0,6–0,7%). Высокий процент лизина (3,3%) наблюдается в авенине овса (перечислены названия проламинов различных злаковых культур). Проламины также бедны треонином, триптофаном, аргинином и гистидином. Зеин кукурузы, оризин риса, кафирин сорго отличаются высоким содержанием лейцина (16,9–18,6%). По содержанию метионина выделяют глиадин пшеницы – 1,2%, авенин овса – 3,7%.
Небольшое количество указанных аминокислот в проламинах компенсируется относительно большим содержанием данной фракции в суммарном белке большинства злаков.
Проламины нерастворимы в воде, солевых растворах, кислотах и щелочах. Они растворяются в 70%-ном спирте, что связано с наличием большого количества неполярной аминокислоты пролина.
Проламины практически отсутствуют в бобовых и масличных культурах.
Глютелины – растительные белки, растворимые в щелочах, что объясняется большим содержанием аргинина. Они занимают промежуточное положение между проламинами и глобулинами. Содержание лизина, аргинина, и гистидина в них больше чем в проламинах. Так, содержание лизина в глютелине пшеницы составляет 2,6%, в глютелине ржи – 2,3%, ячменя – 4,0%, овса – 5%. Глютелины ячменя, риса и овса отличаются от глютелина пшеницы (глютенина) более высоким уровнем лизина. Например, у риса 80% всего белка приходится на глютелины (оризенин), этим можно объяснить удовлетворительное содержание лизина (2,6–4,0%) в общем белке рисового зерна. Преобладающими фракциями овса являются глобулины и глютелины, содержащие 5–5,5% лизина, что также обеспечивает хорошую сбалансированность данной культуры по лизину.
Протеиноиды – белки опорных тканей (костей, хрящей, связок, сухожилий, ногтей, волос, эпидермиса кожи).
Это фибриллярные белки, имеют β-конфигурацию полипептидных цепей, молекулы которых образуют многомолекулярные нитевидные комплексы – фибриллы. Самые распространенные в природе: фиброин, коллаген, кератин, эластин. Они могут иметь третичную и четвертичную структуры. Протеиноиды нерастворимы в воде – только в специальных растворителях. Не перевариваются в желудочно-кишечном тракте большинства животных и человека. Однако, некоторые членистоногие приспособились к питанию фибриллярными белками кожи, перьев птиц, шерсти (например, моль).
Характеристика представителей протеиноидов:
Фиброин – белок шелка. Его β-структура состоит из антипараллельных полипептидных цепей, связанных между собой водородными связями.
α-Кератин – составляет эпидермис кожи, волосы, ногти, рога. Полипептидные цепи этих белков имеют конформацию α-спирали. В волосе три такие цепи, скрученные в суперспираль, образуют протофибриллу. Несколько протофибрилл вновь образуют спиральный жгут – микрофибриллу. Жгут из микрофибрилл образует макрофибриллу. Многожильный канат одного волоса содержит сотни макрофибрилл. Молекулы α-кератина ориентированы параллельно и соединены дисульфидными связями (содержат много цистеина), что придает прочность структуре.
Коллаген – самый распространенный белок в мире животных. Он составляет 1/3 от общего количества белка позвоночных. Более 80% всего коллагена организма находится в межклеточном веществе соединительной ткани кожи, костей, связок, сухожилий, хрящей. Эти ткани обладают малой растяжимостью и высокой прочностью.
Полипептидная цепь коллагена содержит приблизительно 1000 аминокислот. Она построена из повторяющейся тройки аминокислот – гли-А-В, где А и В чаще всего представлены пролином или гидроксипролином. На долю глицина приходится 30%, пролина и гидроксипролина – 20%, аланина – 10%, остальных аминокислот – 40%. Коллаген единственный белок, в состав которого входит гидроксипролин.
Полипептидные цепи коллагена при формировании вторичной и третичной структуры не могут давать типичные α-спирали, так как этому мешают антиспиральные аминокислоты – глицин, пролин и гидроксипролин (они не образуют достаточного количества водородных связей).
Три α-цепи коллагена ориентированы параллельно и перевиты между собой, образуя субъединицу – тропоколлаген (микрофибриллу), представляющий собой плотный жгут:
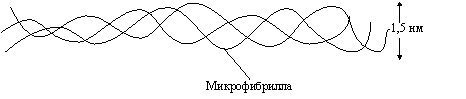
Между полипептидными цепями микрофибрилл (тропоколлагена) образуются водородные, гидрофобные и ионные связи.
Из тропоколлагена формируется четвертичная структура. Молекулы тропоколлагена сшиваются между собой поперечными ковалентными связями за счет аминогрупп радикалов лизина в более толстые коллагеновые фибриллы, а из них затем образуются волокна и пучки волокон:
 Тропоколлаген
Тропоколлаген

В ходе образования коллагена (созревания) многие остатки пролина и лизина гидроксилируются при участии аскорбиновой кислоты, которая выступает в качестве кофактора:
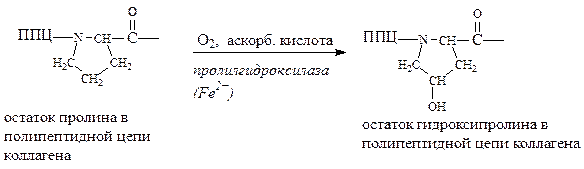
Витамин С необходим для поддержания в восстановленном состоянии ионов Fe2+ в активном центре фермента пролилгидроксилазы и для активации (восстановления) кислорода:
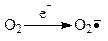
При авитаминозе С нарушается формирование прочной структуры коллагена, что приводит к разрыхлению соединительной ткани.
Помимо ковалентных свзей три спирально навитые друг на друга молекулы тропоколлагена в структуре коллагеновых фибрилл имеют дополнительную стабилизацию, которую формируют водородные связи при участии гидроксилированных остатков лизина и пролина.
Например, сухожилия представляют собой пучки параллельно ориентированных коллагеновых фибрилл. В отличие от сухожилий, в коже коллагеновые фибриллы образуют подобие неупорядоченной двухмерной сетки.
Пустоты в коллагеновых фибриллах могут служить местом первоначального отложения кристаллов гидроксиапатита – Са5(ОН)(РО4)3, играющего важную роль в минерализации костей.
Известно несколько типов коллагенов, различающихся структурой полипептидных цепей, укладкой их во вторичную третичную и четвертичную структуры, степенью гликозилирования.
Генетически обусловленные нарушения созревания коллагена после синтеза его полипептидных цепей на рибосомах приводит к тяжелым наследственным заболеваниям – коллагенозам.
Все гликозаминогликаны (гетерополисахаридные цепи протеогликанов), содержащие уроновые кислоты и сульфатные группы при нейтральных значениях рН электростатически связываются с коллагеном. С каждым коллагеновым мономером связывается от 2 до 5 хондроитинсульфатных цепей протеогликанов. С эластином также специфически связываются хондроитинсульфаты и гепарансульфаты
Эластин – содержится в больших количествах в межклеточном веществе соединительных тканей, испытывающих периодические растяжения и сокращения. Это гладкие мышцы крупных кровеносных сосудов, связок, легких.
Например, в аорте эластин составляет 30–60% от массы вещества ткани, в выйной связке – 70–80%.
Структура эластина менее изучена. Как и коллаген, эластин содержит много глицина (30%) и аланина (21%), но мало гидроксипролина и нет гидроксилизина. В его состав входят также лейцин (10%), лизин (10%), валин (13%) и другие гидрофобные аминокислоты.
Эластин основной компонент эластических волокон соединительной ткани, резиноподобный полимер.
Он содержит обычные α-спирали, но благодаря некоторым особенностям строения молекулы эластина обладают упругостью большей, чем резина. Эластин образует поперечно-сшитую сеть, которая своими необычными механическими свойствами обязана уникальному способу ковалентного связывания боковых цепей лизина: четыре сближенных лизиновых остатка ферментативно формируют так называемую десмозиновую структуру, объединяющую в один узел четыре участка полипептидных цепей:

Организованные таким образом полипептидные цепи тропоэластина могут соединяться в системы, способные обратимо растягиваться во всех направлениях.
Эластин не растворяется в холодной и горячей воде, в солевых растворах, разведенных кислотах и щелочах. Даже крепкая серная кислота оказывает на него слабое действие. Из эластина не образуется желатин. Изоэлектрическая точка смещена в слабокислую сторону, поскольку незначительно преобладают кислые аминокислоты. В водной среде полипептидные цепи эластина принимают форму глобулы, которая окружена гидратной оболочкой. Гидрофобные радикалы аминокислот, образующие соответсвующие связи, спрятаны внутри белковой молекулы.
Эластин не переваривается трипсином и химотрипсином, очень медленно гидролизуется пепсином в кислой среде при рН 2. В тонком кишечнике эластин расщепляется эластазой поджелудочной железы до аминокислот, пептидов и поперечно-сшитых пептидов. В пищевой промышленности для интенсификации процессов обработки и созревания мяса (коллагена, эластина, миозина) применяют ферментные препараты растительного (папаин, фицин, бромелаин) и микробного происхождения.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 2819; Нарушение авторских прав?; Мы поможем в написании вашей работы!