
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Спектральные закономерности излучения атома водорода
|
|
|
|
Исследования спектров излучения разреженных газов (т.е. спектров излучения отдельных атомов) показали, что каждому газу присущ определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр наиболее простого атома — атома водорода.
Электрон может переходить скачком с одной орбиты на другую. Переход с более удаленной орбиты на более близкую связан с испусканием одного фотона, - такова причина возникновения характерного для одноатомного вещества, в данном случае водорода, линейчатого спектра.
Швейцарский ученый И. Бальмер (1825—1898) подобрал эмпирическую формулу, описывающую спектральные линии излучения атома водорода в видимой области спектра:

где R/= 1,1·107 м-1 - постоянная Ридберга. Умножив левую и правую части уравнения на скорость с света в вакууме получим:
 , ,
| (23.2.1) |
где R=R/ c= 3,29 1015 c -1 - постоянная Ридберга, n - номер орбиты, на которую перешел электрон, 2 - номер орбиты, с которой он перешел при испускании данного фотона.
Из формулы (23.2.1) вытекает, что спектральные линии, отличающиеся различными значениями n, образуют группу или серию линий, называемую серией Бальмера. С увеличением n линии серии Бальмера сближаются;и значение n=¥ определяет границу серии, к которой со стороны больших частот примыкает сплошной спектр.
В дальнейшем в спектре атома водорода было обнаружено еще несколько серий. В ультрафиолетовой области спектра находится серия Лаймана:
 . .
| (23.2.2) |
В инфракрасной области спектра были также обнаружены:
серия Пашена
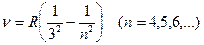 ; ;
| (23.2.3) |
серия Брэкета
 ; ;
| (23.2.4) |
серия Пфунда
 ; ;
| (23.2.5) |
серия Хэмфри
 . .
| (23.2.6) |
Анализируя уравнения (23.2.1) – (23.2.6) можно записать общее уравнение, описывающее все сериальные закономерности излучения атома водорода
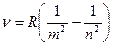 , ,
| (23.2.7) |
где m- номер орбиты, на которую перешел электрон при испускании фотона, m < n, m = 1, 2, 3, 4, 5, 6.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 738; Нарушение авторских прав?; Мы поможем в написании вашей работы!