
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Спектр атома водорода по теории Бора. Потенциал ионизации
|
|
|
|
Постулаты, выдвинутые Н. Бором, позволили рассчитать спектр атома водорода и водородоподобных систем – систем, состоящихиз ядра с зарядом Ze и одного электрона (например, ионы He+, Li2+, Be3+), а также теоретически вычислить постоянную Ридберга.
Рассмотрим электрон, который движется вокруг ядра по круговой орбите радиуса r. При этом сила кулоновского взаимодействия между ядром и электроном сообщает электрону центростремительное ускорение. Тогда по второму закону Ньютона:
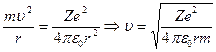
Из первого постулата Бора
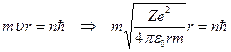 (23.4.1)
(23.4.1)
Из уравнения (23.4.1) следует, что радиус n-й стационарной орбиты:
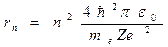 , ,
| (23.4.2) |
где n= 1, 2, 3,...– номер орбиты
Для атома водорода (Z = 1) радиус первой орбиты электрона при n = 1, называемый первым боровским радиусом (а), равен
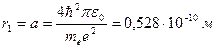
| (23.4.3) |
Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии (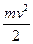 ) и потенциальной энергии в электростатическом поле ядра (
) и потенциальной энергии в электростатическом поле ядра (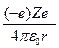 ):
):
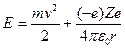
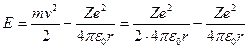
Отсюда следует, что
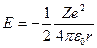
| (23.4.4) |
Подставляя выражение (23.4.3) в (23.4.4) получим, что энергия электрона может принимать только следующие дискретные значения:
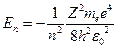 (n=1, 2, 3, 4,...), (n=1, 2, 3, 4,...),
| (23.4.5) |
где знак минус означает, что электрон находится в связанном состоянии.
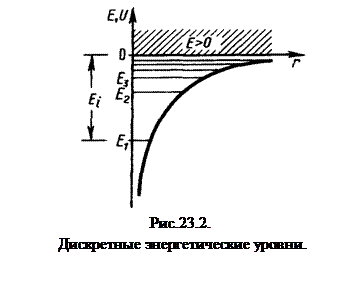 |
Целое число п в выражении (23.4.5), определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние с n = 1 является основным (нормальным) состоянием; состояния с n > 1 являются возбужденными. Энергетический уровень, соответствующий основному состоянию атома, называетсяосновным (нормальным) уровнем; все остальные уровни являютсявозбужденными.
Придавая различные значения п, получим для атома водорода различные энергетические уровни представленный на рис.23.2. Энергия атома водорода с увеличением n возрастает и энергетические спектры сближаются к границе, соответствующей значению n =∞. Таким образом, атом водорода обладает минимальной энергией Е1=13,55 эВ при п =1 и максимальной Е∞=0 при n =∞. Значение Е∞=0 соответствует ионизации атома (т.е. отрава от него электрона).
Согласно второму постулату Бора, при переходе атома водорода из стационарного состояния n в стационарное состояние m с меньшей энергией испускается квант:
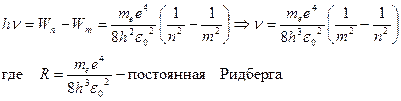
Значение постоянной Ридберга, рассчитанная, таким образом, теоретически полностью совпала с экспериментальными данными. Это совпадение доказывает правильность формулы Бора (энергия, соответствующей различным энергетическим уровням).
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 812; Нарушение авторских прав?; Мы поможем в написании вашей работы!