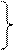КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ізобарний процес
|
|
|
|
Ізохорний процес
Ізохорним називають процес, який протікає з постійним об'ємом V =const.
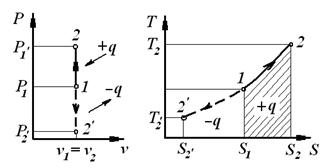
| 1.  - закон Шарля.
2. - закон Шарля.
2. 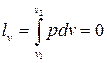 3.
3. 
| |||
Процеси:
1– 2 – підведення теплоти;
 – відведення теплоти. – відведення теплоти.
|
6. 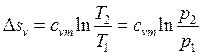
7. Схема енергобалансу: теплота, що підводиться, витрачається на зміну внутрішньої енергії.
Ізобарним називається процес, який протікає з постійним тиском P =const.
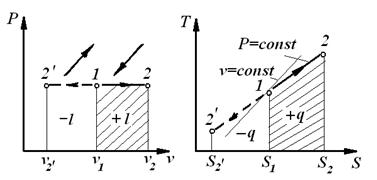
| 1.  – закон Гей-Люссака.
2. – закон Гей-Люссака.
2.  .
3. .
3.  .
6. .
6. 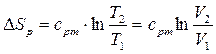 . .
|
Процеси:
1– 2 – розширення, підведення теплоти;
 – стиск, відведення теплоти. – стиск, відведення теплоти.
| |
| 7. Схема енергобалансу: теплота, що підводиться, витрачається на здійснення роботи і зміну внутрішньої енергії. |
3.3. Ізотермічний процес
Ізотермічним називають процес, який протікає з постійною температурою T =const. Підкоряється рівнянню 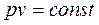 . У P-V координатах ізотерма являє собою рівнобічну гіперболу.
. У P-V координатах ізотерма являє собою рівнобічну гіперболу.

| 1.. Закон Бойля – Маріотта.
2.  Δ uT =0; Δ iT =0.
3.
Δ uT =0; Δ iT =0.
3.  6.
6. 
|
Процеси: 1-2 – розширення, підведення теплоти;
 - стиск, відведення теплоти. - стиск, відведення теплоти.
|
7. Схема енергобалансу: теплота, що підводиться, витрачається на зміну внутрішньої енергії.
3.4. Адіабатний процес
Адіабатним (ізоентропним) називається процес, який протікає без теплообміну з навколишнім середовищем, з постійною ентропією S =const. У P-V координатах адіабата являє собою нерівнобічну гіперболу, показник адіабати  .
.
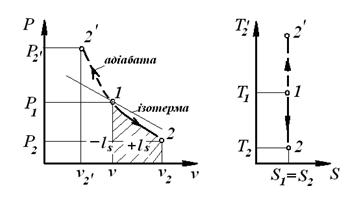 Процеси: 1-2 – розширення,
Процеси: 1-2 – розширення,
 - стиснення. - стиснення.
|  2. ls =Δ u;
2. ls =Δ u;
|
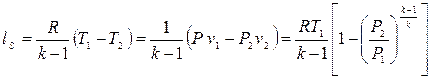
3. qs =0.
6. 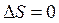 .
.
7. Схема енергобалансу: робота здійснюється за рахунок зменшення внутрішньої енергії.
3.5. Політропний процес
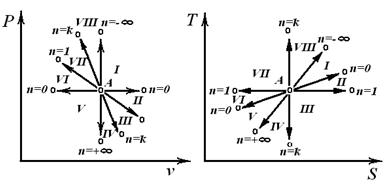
Політропним називається процес, який протікає з постійною теплоємністю  =const і підкоряється рівнянню Pvn= const, де n-показник політропи.
=const і підкоряється рівнянню Pvn= const, де n-показник політропи.
|  

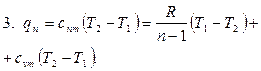
|
| Області: I÷IV – розширення робочого тіла, позитивна робота; V÷VIII – стиск робочого тіла, негативна робота; I÷III,VIII – підведення теплоти; IV÷VIII – відведення теплоти; VII, VIII, I, II – підвищення температури тіла; III, IV, V, VI – зниження температури тіла. | |
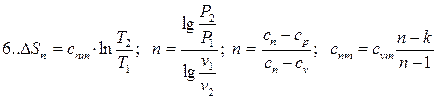
| |
В залежності від величини n поле діаграми P-v і T-S ділиться на вісім частин. Усі процеси починаються в точці А. 
|
4. Термодинамічні процеси в реальних газах і парі
4.1. Властивості реальних газів
Реальним газом (РГ) називається газ, між молекулами якого існують сили тяжіння і відштовхування, а молекули й атоми цього газу мають масу і об'єм. При високому тиску Р і низьких температурах T властивості РГ відхиляються від властивостей ідеальних газів (ІГ). Істотною відмінністю є те, що РГ може перебувати в газоподібному, рідкому і твердому стані. Згідно правил фаз Гіббса для чистої речовини в однофазному стані незалежно можуть змінюватися два параметри (наприклад Р і T), в двофазному стані – тільки один (наприклад, або T, або Р), в трифазному стані три фази можуть знаходиться в рівновазі при цілком визначених Р і T. Відмінність властивостей РГ від ІГ визначається по коефіцієнту стисливості  .
.
Для ідеального газу Z =1, для реального 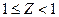 .
.
Рівняння стану Ван-дер-Ваальса:

а, b – постійні коефіцієнти, які залежать від природи газу;
v – власний об'єм молекул;
 - внутрішній тиск.
- внутрішній тиск.
Приведене рівняння Ван-дер-Ваальса:

 .
.
4.2. Фазові переходи
Рівноважне співіснування декількох, дотичних між собою фаз речовин, які переходять одна в одну, називається фазовою рівновагою. Перехід речовини з однієї фази в іншу називається фазовим переходом. Перехід з твердої фази в рідку – плавлення. Перехід з рідкої фази в пароподібну: випаровування – пароутворення з поверхні рідини, кипіння – бурхливе пароутворення в об'ємі з паровими міхурами. Перехід з пароподібного стану в рідкий – конденсація. Перехід з твердої фази у пароподібну – сублімація. Криві фазових переходів зображаються в P-t діаграмі.
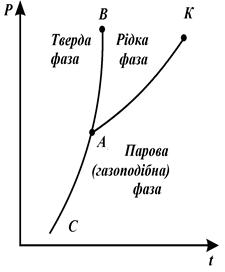
| Рівноважні криві: АВ – плавлення; АК – пароутворення; АС – сублімація. Точка, у якій речовина існує в трьох агрегатних станах, називається потрійною точкою (т.А). Лінія пароутворення закінчується критичною точкою К. Її параметри. У цій точці: 1. Питомий об'єм рідини і газу рівні один одному. 2. Рідина переходить в пару минувши двофазний стан. Ніяким зусиллям стиснення неможливо сконденсувати пару. |
Теплота, що витрачається на перехід 1 кг речовини з одного агрегатного стану в інший називається теплотою фазового переходу. Вона витрачається на руйнування кристалічних грат, на розрив зв'язку між молекулами. Розрізняють теплоту плавлення, сублімації і паротворення (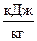 ).
).
4.3 Пари, основні визначення
Пара, що перебуває в динамічній рівновазі з рідиною, називається насиченою. ЇЇ стан характеризується тиском насичення Р н, і температурою насичення t н, причому t н= f (Р н). Пара, що не містить крапель рідини і температура якої дорівнює температурі насичення, називається сухою насиченою (с.н.п.). Суміш с.н.п. із крапельками рідини називається вологою насиченою парою (в.н.п.) і характеризується степенем сухості х
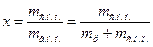 ;
;
Для рідини, нагрітої до t н x =0, а для с.н.п. x =1.
Величина (1- x) називається степенем вологості.
Пара, температура якої вище температури насичення при даному тиску, називається перегрітою.
4.4 Процес паротворення в P-υ і T-S координатах
Якщо при t =0°C і тиску Р підводити до 1 кг води теплоту, на рисунку - точка а, то одержують наступні процеси: ab – підігрів до температури кипіння (t н), bс – процес пароутворення; cd – перегрів пари. У точці b вода закипить, а у точці с вся перейде в пару та стане сухою насиченою. При збільшенні тиску до Р' одержують аналогічні процеси: a'b', b'c' і c'd'. Область діаграми від осі Р до лінії А'А – твердий стан речовини, між лініями А'А і АК – рідинний, між АК і КМ – стан в.н.п., праворуч від лінії АМ – перегріта пара. Лінії: А'А – крива плавлення; АК – ліва або нижня погранична крива, кожна точка лінії відповідає рідині, нагрітої до температури кипіння (t н), для неї х =0; КМ – права (верхня) погранична крива, кожна точка лінії відповідає с.н.п., х =1. Точка К – критична точка.
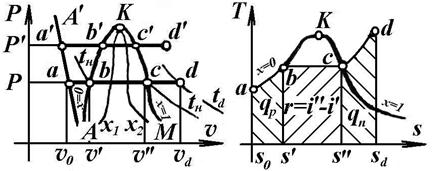
В T-S координатах площі під лініями: ab – теплота на нагрівання рідини до t н – q р; bc – теплота пароутворення r, кДж/кг; cd – теплота на нагрівання пари – q п.
4.5 Параметри рідини і пари
1. Параметри рідини, нагрітої до температури насичення t н позначаються “ ' ”.
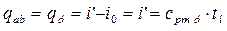 ;
;
i0= 0 при t =0°C.
 ;
;
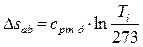 .
.
2. Параметри в.н.п. позначаються індексом “ x ”.
vх = xv '' + (1 - x) v ';
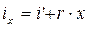 ;
;
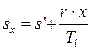 ;
;
 ;
;
3. Параметри с.н.п. позначаються “ '' ”:
i ''= i ' + r
u '' = i ''- рн v ''
4. Параметри перегрітої пари:
qп.п = i - i '' = cрт п (t - tн)
∆ 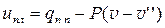
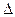 s = s - s '' = cрт п ×ln(T/Tн)
s = s - s '' = cрт п ×ln(T/Tн)
і, s – відповідно ентальпія, ентропія перегрітої пари.
Рівняння стану пари Вукаловича - Новикова:

с/, m - коефіцієнти степені асоціації.
5. Вологе повітря
Вологе повітря - суміш сухого повітря з водяною парою. Суміш сухого повітря з перегрітою парою - ненасичене вологе повітря. Суміш сухого повітря із сухою насиченою парою - насичене вологе повітря. Вологе повітря підпорядковується закону Дальтона:
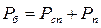
де 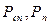 - парціальні тиски сухого повітря й водяної пари.
- парціальні тиски сухого повітря й водяної пари.
Розрахунок процесів вологого повітря ведеться на 1 кг сухого повітря, змінною величиною є кількість водяної пари. Перехід з ненасиченого стану в насичене йде двома шляхами:
1. При t =const насичується повітря водяною парою, на початку процесу 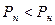 , наприкінці процесу
, наприкінці процесу 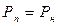 , де Р н – парційний тиск пари в стані насичення.
, де Р н – парційний тиск пари в стані насичення.
2. При Р =const повітря охолоджується, на початку процесу  , наприкінці процесу
, наприкінці процесу 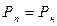 , кількість водяної пари не змінюється. Температура, при якій повітря з ненасиченого стану переходить у насичений при охолодженні, називається температурою точки роси t т.р. Параметри вологого повітря:
, кількість водяної пари не змінюється. Температура, при якій повітря з ненасиченого стану переходить у насичений при охолодженні, називається температурою точки роси t т.р. Параметри вологого повітря:
1. Кількість водяної пари в 1 м3 повітря називається абсолютною вологістю, яка чисельно дорівнює густині пари
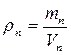 ,
, 
2. Відношення абсолютної вологості до максимально можливої абсолютної вологості (стан насичення), називається відносною вологістю
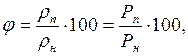 %
%
3. Відношення маси водяної пари до маси сухого повітря називається вологовмістом -

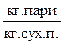 ,
,
максимальний вологовміст 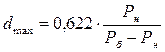 ,
, 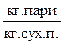 .
.
Відношення вологовмісту до максимального вологовмісту називається степенем насичення 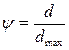 .
.
4. Густина вологого повітря
 , або
, або 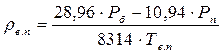
де Р б – барометричний тиск повітря; Т в.п. – температура вологого повітря, К; ρ с.п. – густина сухого повітря (с.п.).
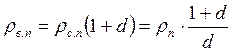 ;
;
5. Теплоємність вологого повітря
 ,
, 
6. Ентальпія вологого повітря
І  ;
;
І  ,
, 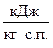
Процеси вологого повітря в I - d діаграмі:
1. нагрівання, охолодження - лінія d =const;
2. адіабатне зволоження (осушення) – лінія І =const;
3. ізотермічне зволоження (осушення)- лінія t =const;
4. змішування - зображається в діаграмі прямою лінією, що з’єднує точки, які характеризують параметри потоків. Точка, що характеризує параметри суміші, знаходить на цій лінії по правилу важеля.
6. Витікання та дроселювання газів і пари
Витіканням називається рух газу через короткі канали особливої форми. Якщо в каналі збільшується швидкість газу, а тиск падає, то такий канал називають сопло. Якщо в каналі зменшується швидкість руху, а тиск збільшується – дифузор. Розрахунковими величинами в процесах витікання є швидкість у вихідному перетині каналу та масова витрата газу. Час перебування газу в коротких каналах невеликий, тому теплообміном між газом і стінкою можна зневажити, що дає можливість вважати процес витікання адіабатним, тоді S =const. Сопло і дифузор виконують свої функції доти, поки швидкість газу на вході в канал менша за швидкість звуку в середовищі витікання. Як тільки вхідна швидкість w 1 дорівнює швидкості звуку і більша за неї, то сопло гальмує потік, а дифузор прискорює.

Сопло

| Диффузор
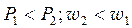
|
Перший закон термодинаміки для потоку для випадку витікання
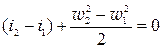
Тоді вихідна швидкість

де 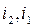 - етальпія газу на вході та виході каналу
- етальпія газу на вході та виході каналу
Через параметри стану для звужуючого сопла

Масова витрата

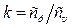 - показник адіабати; f 2 - площа поперечного перерізу на виході з каналу;.
- показник адіабати; f 2 - площа поперечного перерізу на виході з каналу;.
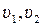 - питомі об’єми газів на вході та виході з каналу.
- питомі об’єми газів на вході та виході з каналу.
Зі зменшенням відношення Р 2/ Р 1 наступає момент, коли швидкість і масова витрата газу через сопло не змінюється, вони досягають максимального (критичного) значення. Таке відношення тиску називають критичним:

Критична (максимальна) швидкість і витрата:
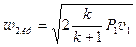 ;
; 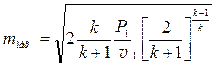
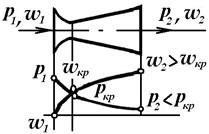
Критична швидкість на виході із звужуючого сопла дорівнює швидкості звуку в середовищі витікання. Для переходу через швидкість звуку використовується комбіноване сопло Лаваля, що складається звужуючої та розширюючоїся частини.
Лінія Кln відповідає дійсній витраті газу, а Кl0 – теоретичній.

| 
|
| Залежність витрати від відношення тисків | Схема сопла Лаваля |
Дроселюванням називається явище зниження тиску при проходженні потоком місцевого опору в трубопроводі. Дроселювання ідеального газу характеризується i =const, тобто i 2= i 1 і t 2= t 1. При дроселюванні реального газу температура після дроселювання може бути рівною, більшою або меншою за температуру до дроселювання (ефект Джоуля-Томсона). Якщо температури рівні, то температуру t 2 називають температурою інверсії. Відношення 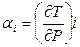 називається диференціальний дросель ефект, а відношення Δ Т /Δ Р - інтегральний дросель ефект.
називається диференціальний дросель ефект, а відношення Δ Т /Δ Р - інтегральний дросель ефект.
7. Термодинамічні процеси в компресорах
Компресор - це пристрій, призначений для стискування газів. У залежності від робочого органа, що здійснює стиск, вони підрозділяються на два основних типи: поршневі і відцентрові. У поршневих газ стискується поршнем у циліндрі, а у відцентрових - колесом з робочими лопатками, розташованими по ободу колеса.

| 
| 
|
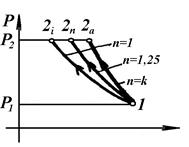
| Процеси в ідеальному компресорі | Процеси в реальному компресорі | Процеси стиску |
Процеси в ідеальному і реальному компресорі: 4-1 – всмоктування газу в циліндр 1, робота всмоктування – площа 4-1-V 1- 0; 1-2 – стиск газу, робота стискування – площа V 1 -1-2-V 2; 2-3 – виштовхування газу із циліндра, робота виштовхування – площа V 2 -2-3-0-V 2; 3-4 – миттєве падіння тиску, L =0. Газ виштовхується поршнем 2.
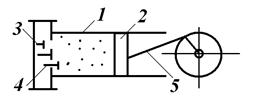
Принципова схема поршневого компресора
Діаграма реального компресора називається індикаторною. У реальному компресорі між поршнем і кришкою циліндра є шкідливий простір з об’ємом V 0, де газ розширюється по лінії 3-4. Вигини в процесах 2-3 і 4-1 пояснюється запізнюванням спрацьовування нагнітального 3 і всмоктувального 4 клапанів. Поршень здійснює зворотно-поступальний рух кривошипно-шатунним механізмом 5. Робочий об’єм циліндра V 1; V h – дійсний об’єм всмоктування.
Процеси стискування можуть проходити по адіабаті 1-2а, політропі – 1-2n, ізотермі – 1-2і. Найменша робота, яка затрачується на стискування відповідає ізотермічному процесу, що видно з порівняння площ: пл. Р 1 -2і-Р 2 -Р 1<пл. Р 1 -1-2п-Р 2 -Р 1< пл. Р 1 -1-2а-Р 2 -Р 1, або 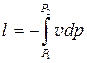 . У реальному компресорі стискування іде по політропі з показником n =1,25÷1,3. Технічна робота компресора питома та повна:
. У реальному компресорі стискування іде по політропі з показником n =1,25÷1,3. Технічна робота компресора питома та повна:
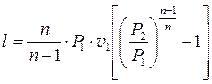 ;
; 
В одноступінчастому (одноциліндровому) компресорі неможливо отримати високий тиск газу, оскільки при стискуванні підвищується температура газу, яка може досягнути до температури спалаху масла. Тому застосовується багатоступінчастий стиск, при цьому між ступенями 1, розташовуються теплообмінники для охолодження газу 2. Процес стискування наближається до ізотермічного.
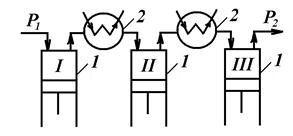
Багатоступінчастий стиск
8. Цикли ДВЗ (двигунів внутрішнього згоряння)
Основні елементи ДВЗ: циліндр, поршень, КШМ, всмоктувальні і нагнітальні клапана. По способу підведення теплоти в циклі (спалюванню палива) ДВЗ підрозділяються:
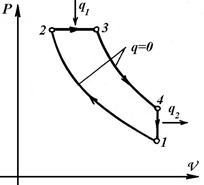
1. Цикл із підведенням теплоти при V =const - карбюраторні двигуни, цикл Отто.
2. Цикл із підведенням теплоти при Р =const - дизельні двигуни, цикл Дизеля.
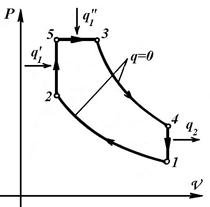
3. Цикл зі змішаним підведенням теплоти при V =const і Р =const - цикл Трінклера.

| 
|  q 1= q 1'+ q 1''
q 1= q 1'+ q 1''
|
| Цикл Отто | Цикл Дизеля | Цикл Трінклера |
Крайні положення поршня, у яких рух поршня змінюється на протилежний, називаються: у кришки циліндра - верхня мертва точка; протилежна - нижня мертва точка (ВМТ і НМТ).
Рух від однієї точки до іншої називається тактом, а пройдена відстань - ходом поршня.
Термічний к.к.д.

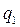 - підводиться теплота,
- підводиться теплота, 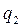 - відводиться теплота
- відводиться теплота
Термічні к.к.д.
| Цикл Отто | Цикл Дизеля | Цикл Трінклера |
 ; ;
| 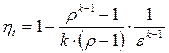 , ,
| 
|
 - ступінь стиску (
- ступінь стиску (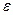 =7÷10)
=7÷10)
 - ступінь попереднього розширення(
- ступінь попереднього розширення(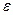 =15÷17)
=15÷17)
 - ступінь підвищеного тиску
- ступінь підвищеного тиску
Процеси ДВЗ: 1-2 – адіабатний стиск паливо-повітряної суміші в циліндрі (у циклах Дизеля та Трінклера стискується повітря); 2-3, 2-5-3 – горіння палива, підведення теплоти q 1; 3-4 – адіабатне розширення газів, робочий хід поршня, здійснення роботи; 4-1 – ізохорний вихлоп газів, відведення теплоти q 2 у циклі. У циклі Отто паливо запалюється електричною свічею, а в циклах Дизеля та Трінклера - за рахунок високої температури стисненого повітря. Цикли ідеалізовані, чотиритактні.
САМОСТІЙНО: порівняння циклів ДВЗ.
9. Цикли ГТУ (газотурбінних установок)
По способу підведення теплоти в циклі ГТУ підрозділяються:
1. Цикл із підведенням теплоти при P =const.
2. Цикл із підведенням теплоти при V =const.
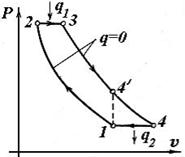
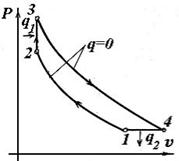
| 
|
| Ідеальний цикл ГТУ при Р =const. | Ідеальний цикл ГТУ при v =const. |
Термічний к.к.д. ГТУ з P =const: 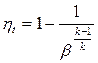

Ступінь підвищення тиску: 
 Газотурбінна установка
Газотурбінна установка
| В установці на одному валу розташований: відцентровий компресор 1, паливний насос 3, газова турбіна 6, електрогенератор 8. Процеси циклу: 1-2 - адіабатний стиск повітря у відцентровому компресорі 1; 2-3 – ізобарний або ізохорний процеси горіння палива, підведення теплоти q 1 у циклі; горіння відбувається в камері згоряння 2. Паливо в камеру подається насосом 3 з паливного бака; |
3-4 - адіабатне розширення продуктів згоряння в соплах 4 і лопатках 6, робочого колеса газової турбіни 6; у процесі розширення газу роблять роботу з обертання колеса турбіни й ротора електрогенератора 8. При цьому механічна енергія ротора перетвориться в електричну;
4-1 – ізобарний вихлоп, відвід теплоти q 2 у циклі.
При порівнянні циклів ДВЗ і ГТУ (V =const), термічний к.к.д. ГТУ більше термічного к.к.д. ДВЗ на величину площі 1-4 '- 4-1 (заштрихована).
|
|
|
|
|
Дата добавления: 2014-11-08; Просмотров: 3526; Нарушение авторских прав?; Мы поможем в написании вашей работы!
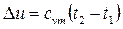 5.
5.