
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
С гибридизацией АО
|
|
|
|
| Тип гибридизации | Структура молекулы | Валентный угол |
| sp |  линейная линейная
| 180о |
| sp2 | 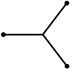 плоский треугольник плоский треугольник
| 120о |
| sp3 | 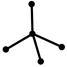 тетраэдр тетраэдр
| 109,3о |
4.1 sp-гибридизация (2А подгруппа или d-элемент)
Молекула ВеСl2
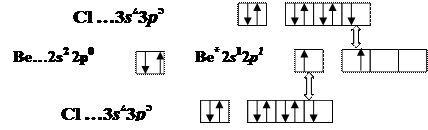
Cl Be Cl
sp -гибридизация АО Ве, валентный угол Ð180о
пространственная структура линейная,
связь полярная m св ¹ 0, т.к. ЭО(Ве) = 1,5, ЭО(Cl)= 3,0 и ∆ЭО≠0
m мол = S m св = 0 Þ молекула в целом неполярная Cl Be ® Cl
4.2. sp2-гибридизация (3А подгруппа)
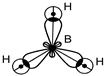 Молекула ВН3
Молекула ВН3

 В* 2 s1 2 p2
В* 2 s1 2 p2
 |
H 1 s H 1 s H 1 s
 sp 2–гибридизация АО В, 3 s - связи, Ð 120°, связи полярные DЭО = (2.1-2.0) ¹ 0, m св ¹ 0
sp 2–гибридизация АО В, 3 s - связи, Ð 120°, связи полярные DЭО = (2.1-2.0) ¹ 0, m св ¹ 0
структура молекулы - плоский треугольник

 m мол = S m св = 0 Þ молекула ВН3 - неполярная
m мол = S m св = 0 Þ молекула ВН3 - неполярная
Аналогично для BCl3, но BFCl2 – полярная молекула m мол = S m св ≠ 0
 |
F
 m мол
m мол
 |
BFCl2 Cl Cl
4.3. sp3-гибридизация (4А подгруппа)
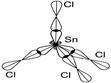
Молекула SnCl4
 Si * 5 s 5 pCl 3 s 3 p
Si * 5 s 5 pCl 3 s 3 p
 |
 ClCl Cl
ClCl Cl
одна s -АО и три р- АО Þ sp 3- гибридизация АО Sn m св


 структура молекулы Þ тетраэдр, Ð 109,30
структура молекулы Þ тетраэдр, Ð 109,30
связи полярные DЭО = (3.0-1.8) ¹ 0, m св ¹ 0
S m св= 0 - молекула в целом неполярная
Аналогично для СCl4но СFCl3 – полярная молекула
4.4. В гибридизации участвуют не только АО связывающих электронов, но и АО неподеленных электронных пар (НП)
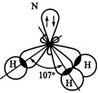 Молекулы NН3 Н2О
Молекулы NН3 Н2О
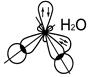
 N …2 s 22 p 3 O …2 s 22 p 4
N …2 s 22 p 3 O …2 s 22 p 4
H 1 s 1 H 1 s 1 H 1 s 1 Н 1 s 1 Н 1 s 1 Н2О NН3
Валентные углы для NH3 107,3º и Н2О 104,5º (близки к тетраэдрическому 109,3º)
Это позволяет предположить sp 3–гибридизацию АО N в молекуле NН3 и Ов молекуле Н2О.
Неподеленные электронные пары (НП) влияют на величину валентных углов, силы отталкивания между ними больше, чем между относительно закрепленными связывающими электронными парами (СП).
В молекуле NН3 одна НП уменьшает тетраэдрический угол (109,3о) до 107о, а в молекуле Н2О две НП уменьшают его до 104,5о.
Ионная химическая связь
о бразуется при взаимодействии элементов значительно отличающихся по ЭО
П ри ∆ЭО > 1.7 - связь ионная, при ∆ЭО < 1.7 - связь ковалентная полярная. (Чисто ионных связей нет, т.к. нет полного перехода электронов.)
Na+ + Cl - → NaCl
Na - ē→ Na + (катион) Cl + ē→Cl- (анион)
Ионная химическая связь – это электростатическое взаимодействие между противоположно заряженными ионами. Свойства: - ненаправленность и ненасыщенность,
Металлическая химическая связь
притяжение между ионами в узлах кристалла и обобществленными (нелокализованными) валентными электронами.
Металлы имеют кристаллическое строение. В кристалле каждый атом (узлы кристалла) связан от 8 до 12 атомов-соседей особой металлической связью (МС), а обобществленные ē образуют электронный газ. Свойства МС – ненаправленна
Природа МС обуславливает металлические свойства:
- Высокая электропроводность (Cu, Ag, Au, Al, Fe…) и теплопроводность (Ag, Cu…)
- Ковкость (возможность придать форму) и пластичность (деформация без разрушения)
- Металлический блеск (M һν↔ M*)
Взаимодействия между частицами вещества
Между частицами вещества в конденсированном состоянии действуют силы притяжения:
ü вандерваальсовы силы,
ü донорно-акцепторные взаимодействия,
ü водородные межмолекулярные связи.
Вандерваальсовы силы -силы межмолекулярного взаимодействия, проявляющиеся на расстояниях, превосходящих размеры частиц (электростатическая природа)
Еванд = Еинд +Еориен +Едисп Еванд<< Ех.с
Три составляющих вандерваальсовых сил:
1. Ориентационная составляющая или диполь-дипольное взаимодействие - взаимодействие полярных молекул при их сближении
2. Индукционная составляющая - взаимодействие неполярной молекулы с полярной или внешним электрическим полем. Еинд <Еориен
Электрическое поле диполя, действуя на неполярную молекулу, деформирует ее и превращает в индуцированный (наведенный) диполь
3. Дисперсионная составляющая (эффект Лондона) - взаимодействие мгновенных диполей, возникающих за счет флуктуации электрической плотности
Еинд <Еориен <Едисп
Едисп - единственная составляющая вандерваальсовых сил для неполярных молекул
С ↑ åЕ возрастет Ткип жидкостей, а также теплота их испарения.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 439; Нарушение авторских прав?; Мы поможем в написании вашей работы!