
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В области сильного перегрева, водяной пар приближается к идеальному газу
|
|
|
|
Изохоры, как в области влажного насыщенного пара так и перегретого, представляют собой кривые выпуклостью вниз, которые на диаграммах показываются штрихами или выделяются другим цветом.
В области влажного насыщенного пара нанесены лини х = const.
1. Таблицы представляют решения ур-й состояния для реального газа. Они состоят из трех частей:
1) Таблица: термодинамические св-ва воды и водяного пара в состоянии насыщения (аргумент – давление).
2) Таблица: термодинамические св-ва воды и водяного пара в состоянии насыщения (аргумент – температура).
3) Таблица: т.д. свойства воды и перегретого водяного пара.
Таблицы 1,2 имеют один входящий параметр (давление р или температура t)
Лекция №8
Термодинамические св-ва влажного насыщенного пара (0<X<1) не представлены не в одной из этих таблиц. Область влажного насыщенного пара представляет собой часть плоскости, для нахождения точки необходимо знать два параметра. Как указано выше влажный насыщенный пар представляет собой механическую смесь сухого насыщенного пара и кипящей жидкости. Соотношение между массами составляющих смесь, характеризуется степенью сухости Х:
Х = 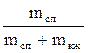
Для определения параметров влажного насыщенного пара может использоваться диаграмма Молье, либо данные первой и второй таблиц
ux = u”x + (1-x)u’
uz = u”x + (1-x)u’
hx = h”x + (1-x)h’ = h”x + h’ – h’x = h’ + x(h” + h’) = h’ + rx
Sx = S”x + (1-x)S’ = S’ + 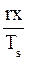
Основные термодинамические процессы воды и водяного пара
Рассмотрим изображения основных термодинамических процессов воды и водяного пара на фазовых pu и Ts и hs диаграммах, а также основные формулы для расчетов этих процессах.
Изобарный процесс
 P T
P T
 K k
K k
 2
2
 |



 1 2
1 2
 1
1




 x=0 x=1 q
x=0 x=1 q
 | |||
 | |||
u u
 h
h
 |

p = const
 |
T = const x=1
 |
s
dq = du + pdu = dh - udp
qp = ∆h = h2 – h1
dl = pdu l = 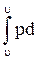 v = p(u2 - u1)
v = p(u2 - u1)
∆u = q – l
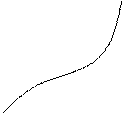
Изохорный процесс

 p T
p T
 2
2
 | |||||
 | |||||
 |
X=0
X=1 u = const
 u s
u s
Возможны два случая реализации изохорного процесса:
1. ux < uкр
2. ux > uкр
Если ux > uкр то при подводе тепла степень сухости пара будет возрастать до х = 1 затем пар будет перегреваться.
Если ux < uкр то при подводе тепла на ряду с увеличением давления будет происходить уменьшение степени сухости пара (т.е. уменьшения кол-ва пара в смеси) при х = 0 весь пар превратиться в жидкость и в дальнейшем будет происходить нагрев воды.
dl = pdu; u = const l = 0
h1 = u1 + p1u1 u1 = h1 – p1u1
h2 = u2 + p2u2 u2 = h2 – p2u2
u2 – u1 = (h2 – p2u1) – (h1 – p1u1) = (h2 – h1) - u1(p2 – p1)
qv = Du
Изотермический процесс
 p К T K
p К T K
 |  |
 1
1
 T=const 1 2
T=const 1 2

 u s
u s
 h
h
q = T(S2 – S1)

 T =const h1 = u1 + p1u1
T =const h1 = u1 + p1u1
h2 = u2 + p2u2 
Du = u2 – u1 = (h2 – h1) – (p2u2 – p1u1)
l = q - Du
 |
s
 Адиабатный процесс
Адиабатный процесс
 p T h
p T h


 1 1 1
1 1 1
 |  | ||||
 | |||||

u 
 s
s
u s
q = 0
q = T(S2 – S1)
h1 = u1 + p1u1
h2 = u2 + p2u2
Du = u2 – u1 = (h2 – h1) – (p2u2 – p1u1)
l = - Du
Уравнение Клапейрона – Клаузиуса
Это уравнение выводится на основании условия фаз равновесия и устанавливает связь между давлением рабочего тела и температурой фазового перехода между давлением рабочего тела и температурой фазового перехода между давлением рабочего тела и температурой.
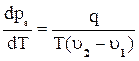 где Т – температура фазового превращения;
где Т – температура фазового превращения;
q – теплота фазового превращения, u и u - удельные объемы фаз
При повышении давления температура насыщения должна возрастать.
В случае фазового превращения твердого тела в жидкость 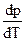 может быть >0 и <0.
может быть >0 и <0.
Лекция №9
Первый закон термодинамики для потока
До настоящего момента рассматривались термодинамические свойства и основные соотношения для неподвижного рабочего тела. В большинстве тепловых машин предназначенных для преобразования теплоты в работу, кинетическая энергия потока газа превращается в механическую энергию. Это преобразование происходит на рабочих лопатках машин, называемых турбинами. Работа, которую совершает газ при этом называется технической.
Рассмотрим первый закон термодинамики газ для потока:











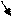

 w1, p1,u1,t1 q
w1, p1,u1,t1 q

Z1
Z2 w2,p2,u2,t2
dq = du + dl; dl – общая работа; l = lпрот + lw + lz + lt + lтр
lпрот – работа проталкивания, которая представляет собой разность между работой которую совершает газ на выходе из каналов и на входе в канал.
lw – работа, затраченная на изменение кинетической энергии потока.
lz – работа, затраченная на изменение потенциальной энергии потока.
lt – техническая работа, т.е. работа против реакции стенок канала.
lтр- работа трения, затраченная на преодоление трения в стенках канала.
lпрот = F2 Dx2 – F1Dx1 = p2f2Dx2 – p1f1Dx1 = p2u2 – p1u1;
lw = 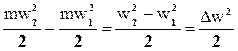 ;
;
lz = mgz2 – mgz1 = gDz (m = 1 кг);
qобщ = q + qтр;
q + qтр = u2 – u1 + p2u2 –p1u1 + gDz + lt + lтр + 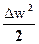 ; qтр = lтр
; qтр = lтр
q = h2 – h1 + 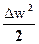 + gDz + lt; dq = dh + d(
+ gDz + lt; dq = dh + d( ) + gdz +dlt;
) + gdz +dlt;
dq = dh + wdw + gdz +dlt; если канал неподвижен, то lt = 0; dq = dh + wdw + gdz (2);
Воспользуемся второй записью первого закона термодинамики:
dq = dh - udp; wdw + gdz = -udp = dlр
lp = -udp; lp = - 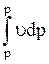 =
= 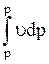 ;
;
p
 Вид данного интеграла зависит от связи
Вид данного интеграла зависит от связи


 между p и u
между p и u

 lp
lp
 | ||
 |
u
Наиболее часто встречающимися процессами расширения и сжатия рабочего тела являются адиабатный, изотермический и политропный.
Для политропного процесса lp = n lп.п., где lп.п. – работа против сил в политропном процессе, тогда lp = n lп.п. = n 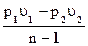 .
.
В случае адиабатного процесса
lp = k 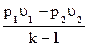 =
= 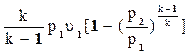 ;
;
Этот процесс встречается при истечении газов и паров через сопло.
q = 0; dq = 0; т.к. сопло имеет малую длину, то можно пренебречь потенциальной энергией потока.
dh + wdw = 0; 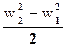 = h1 – h2;
= h1 – h2;
w2 = 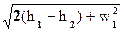 ; h1 – h2 = DhP – располагаемый теплоперепад.
; h1 – h2 = DhP – располагаемый теплоперепад.
При истечении w1 << w2 w» 0;
w2 = 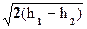 =
= 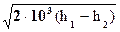 = 44.72
= 44.72 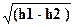
Данная формула используется для нахождения скорости как идеального так и реального газа. Проинтегрировав (2) получаем
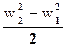 + gDz =
+ gDz = 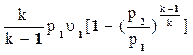
w2 = 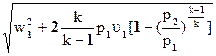 »
» 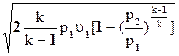
Лекция №10
Скорость звука
Скоростью звука называется скорость распространения малых возмущений в среде (малые возмущения – возмущения, когда местное изменение давления dp мало по сравнению с общим давлением). Определим эту скорость, используя следующую расчетную схему: канал заполнен сжимаемым газом, который имеет давление р и плотность r. В канал вводится поршень, который перемещается со скоростью dw. Площадь поперечного сечения f. Вблизи поверхности поршня образуется некоторый объем возмущенного газа, давление которого – p+dp, плотность - r+dr.
 A f
A f
|









 r+dr r
r+dr r

 p+dp p
p+dp p

A
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 422; Нарушение авторских прав?; Мы поможем в написании вашей работы!