
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Очаговая гнойная инфекция. 3 страница
|
|
|
|
Введение внутрь непатогенных видов кишечной палочки, имеющих иммунологически перекрестно реагирующие капсульные антигены, в целом может повысить активность антител против ПРФ. Однако в связи с полученными данными о необычно высокой частоте кишечного носительства таких кишечных палочек среди детей, страдающих менингитом, вызванным палочкой инфлюэнцы типа b, дальнейшие исследования в этом направлении были прекращены. Другие исследования ставят своей целью изучение роли белков наружной мембраны палочки инфлюэнцы либо как основы вакцины, либо в качестве носителя полисахаридов, с тем чтобы подобная вакцина могла создать эффективную защиту от заболеваний, вызываемых как беекапсульными, так и инкапсулированными штаммами палочки инфлюэнцы.
Haemophilis aegypticus. Этот возбудитель, известный также как палочка Коха—Уикса, вызывает конъюнктивит у человека. Морфологически и биохимически он сходен с бескапсульными формами палочки инфлюэнцы. Более того, H. aegypticus и палочка инфлюэнцы имеют общие антигены и могут трансформироваться под воздействием ДНК других видов бактерий.
Конъюнктивит, вызываемый Н. aegypticus, поражает главным образом детей и встречается повсеместно, часто в форме эпидемических вспышек, в некоторых районах заболевание носит сезонный характер. Его следует отличать от конъюнктивитов, вызываемых хламидиями трахомы, аденовирусами и такими бактериями, как пневмококки, золотистые стафилококки, гонококки. Лечение состоит в местном применении глазных капель или мазей, содержащих противомикробные средства (сульфаниламиды, полимиксин В, гентамицин; 5—6 раз в сутки, а также промывании век специальными лосьонами.
Haemuphilus aphrophilus. Это мелкая, неподвижная, грамотрицательная коккобацилла, требующая для своего роста фактор Х (но не V) и высокой концентрации двуокиси углерода в газовой фазе (оптимально 5%). Хотя он и является составной частью нормальной флоры полости рта, за последнее время все чаще диагностируется в качестве причины многих форм инфекционных заболеваний, в частности, бактериемии, эндокардита и абсцесса мозга. К числу других болезней, вызванных Н. aphrophilus, относят острые и хронические синуситы, пневмонию, эмпиему, остеомиелит, септический артрит, воспаление среднего уха, перитонит, холецистит, периапикальный зубной абсцесс, менингит, абсцесс глубоких тканей, раневую инфекцию и некротизирующий фасциит. Н. aphrophilus может служить причиной заболевания у практически здоровых лиц, однако в большинстве случаев патологический процесс возникает на фоне предрасполагающих условий, таких как злокачественные опухоли, иммунодепрессивные состояния, ревматические или врожденные болезни сердца, рецидивирующее воспаление среднего уха, астма.
Большинство штаммов возбудителя чувствительны ко многим широко применяемым антибиотикам, включая пенициллин, цефалоспорины, аминогликозиды, тетрациклин и левомицетин.
Haemophilus ducreyi. H. ducreyi является возбудителем локализованной венерической болезни, мягкого шанкра (см. гл. 110). В США это заболевание встречается редко, однако оно эндемично в некоторых тропических странах, например, в Кении с ним связано около половины язвенных поражений половых органов. Для роста возбудителя необходим фактор X, но не V. В клинических образцах и в колониях, выросших на твердой питательной среде, возбудитель имеет вид мелких овоидной формы палочек, расположенных попарно, группами или параллельными цепочками. Болезнь характеризуется болезненными неуплотненными изъязвлениями на половых органах и увеличенными, часто нагноившимися, регионарными лимфоузлами. Мягкий шанкр следует отличать от первичного сифилиса; нередко оба заболевания отмечаются одновременно. Даже в наиболее оборудованных лабораториях выделить возбудителя на специальных селективных средах удается лишь в 50—70% случаев. Ввиду увеличения частоты случаев устойчивости возбудителя к сульфаниламидам и тетрациклину, опосредуемой плазмидами, в настоящее время лечение рекомендуется проводить триметопримом — сульфаметоксазолом или эритромицином.
Haemophilus parainfluenzae. В отличие от палочки инфлюэнцы для роста этого возбудителя необходим фактор V, но не X. Тот факт, что в анаэробных условиях палочка инфлюэнцы не требует для своего роста фактора X, может вызвать определенные затруднения при дифференциации этих возбудителей, особенно если проводить ее методом посева уколом в среду. Возможно именно это лежало в основе тех случаев системных форм инфекционных заболеваний, возбудителем которых поначалу считали H. parainfluenzae, но при дальнейшей проверке устанавливали, что им является палочка инфлюэнцы.
Полагают, что H. parainfluenzae вызывает острые респираторные заболевания, воспаление среднего уха и, реже, менингит, пневмонию, а также абсцесс мозга. Менее чем в 1% случаев этот микроорганизм служит причиной эндокардита, причем выделение его при этом заболевании часто происходит с некоторой задержкой (на 6—8 дней) ввиду необходимости создания особых условий для роста возбудителя и слепого пересева на шоколадный агар. H. parainfluenzae необходимо дифференцировать от H. aphrophilus, который вызывает клинически идентичный эндокардит и имеет сходные биохимические свойства. Небольшое, но вместе с тем значительное количество H. parainfluenzae являются носителями плазмид, опосредующих продукцию р-лактамазы и устойчивость к ампициллину.
Коклюш. Возбудитель коклюша (Bordetella pertussis) вызывает острое инфекционное заболевание дыхательных путей, весьма тяжело протекающее у детей младшего возраста, и характеризующееся повторными приступами кашля и затяжным свистящим вдохом. Название болезни pertussis означает сильный кашель, и оно предпочтительнее другого ее наименования — whooping cough, поскольку не у всех больных кашель сопровождается судорожным шумным вдохом во время приступа.
Этиология. Подавляющее большинство случаев коклюшного синдрома вызывается В. pertussis; однако возбудителями идентичных заболеваний могут быть В. parapertussis, В. bronchiseptica и ряд аденовирусов.
Возбудитель коклюша — мелкая, неподвижная, неспорообразующая, аэробная, грамотрицательная коккобацилла с весьма жесткими требованиями к условиям роста. Многие компоненты обычных питательных сред подавляют рост этого микроорганизма. Классической для первичного выделения возбудителя коклюша служит среда Борде — Жангу, содержащая кровь и крахмал. Добавление пенициллина подавляет рост других микроорганизмов. Ввиду отсутствия антигенных связей и невозможности в силу этого трансформировать возбудитель коклюша путем воздействия ДНК палочки инфлюэнцы и наоборот, полагают, что эти виды не являются близкородственными. Для роста коклюшной палочки не требуется присутствия факторов Х или Y, поэтому ее нельзя включить в род гемофилюсов.
Вместе с тем возбудитель коклюша весьма близок с В. parapertussis, вызывающей более легкие, сходные с коклюшем заболевания у людей, и с В. bronchiseptica — причиной респираторных заболеваний у животных и редко у человека. Им требуются сходные, условия культивирования, они одинаковы по морфологическим признакам и различить их между собой можно лишь посредством специфических реакций агглютинации.
Свежевыделенные изоляты В. pertussis образуют S-форму колоний (фаза I), вирулентны, морфологически однородны, инкапсулированы, имеют пили. При пересевах культуры могут возникнуть невирулентные формы (фазы II, III или IV). Для заражения или производства вакцины необходимо, чтобы возбудитель коклюша находился в фазе I.
Эпидемиология. Возбудитель коклюша встречается повсеместно и в естественных условиях поражает только людей, хотя в эксперименте удается заразить низших приматов и мышей. Коклюш является одной из самых контагиозных инфекций, поскольку возбудитель передается воздушно-капельным путем. (Недостаточно изученными остаются инфективность слизи из дыхательных путей и контактные способы передачи.) При контактах с больными у восприимчивых людей заболевание развивается с частотой до 90% (а по данным ряда исследований, до 100%). Редко встречаются бессимптомные случаи инфекции. Хотя коклюш — эндемическое заболевание, среди восприимчивого населения отмечались эпидемические вспышки этой инфекции. Заболеваемость имеет небольшие сезонные колебания. Женщины болеют чаще, чем мужчины, и эта разница увеличивается с возрастом.
Более 50% случаев коклюша у детей раннего возраста обусловлены, по-видимому, недостаточностью материнского иммунитета и, возможно, отсутствием трансплацентарной передачи протективных специфических антител. Хотя полагают, что взрослые люди устойчивы к коклюшу, однако ни перенесенное заболевание, ни активная иммунизация не обеспечивают пожизненного иммунитета; в действительности, возбудитель коклюша нередко служит причиной бронхита у взрослых. В настоящее время более 5% случаев коклюша отмечается у лиц в возрасте старше 15 лет. По данным отчетов о вспышках коклюша, охвативших стационарных больных и больничный персонал, последний также находится под повышенным риском заражения.
В США ежегодно регистрируется около 3000 случаев коклюша, однако многие специалисты считают, что это число значительно занижено вследствие затрудненного бактериологического подтверждения диагноза. Вероятно, зарегистрированные случаи составляют 15—25% от действительного распространения инфекции. До начала широкого проведения активной иммунизации в 40-х годах коклюш был важной причиной заболеваемости и смертности, причем подавляющее большинство летальных исходов отмечалось у детей, не достигших возраста 1 года. С 1944 г. показатель смертности снизился в 85 раз, вместе с тем с 1974 г. он оставался относительно постоянным. Коклюш представляет очень серьезную проблему здравоохранения в развивающихся странах, особенно в местах с низким уровнем питания и охвата населения иммунизацией. В Великобритании снижение уровня иммунизации детей до 30% повлекло за собой эпидемический рост заболеваемости коклюшем до показателей, характерных для довакцинальной эры. Клиническую картину, идентичную коклюшу, могут вызвать определенные аденовирусы, однако, несомненно, что в большинстве случаев заболевание вызывается именно возбудителем коклюша.
Патогенез. Попав в дыхательные пути, возбудитель коклюша I фазы с помощью пилей прикрепляется к клеткам мерцательного эпителия, где он размножается на поверхности слизистой оболочки, не проникая в кровоток. Развивается острый воспалительный процесс: угнетается деятельность ресничного аппарата эпителиальных клеток и стимулируется секреция слизи. Затем происходит изъязвление эпителия дыхательных путей и очаговый некроз. Поражаются главным образом бронхи и бронхиолы; патологический процесс, однако, менее выраженный, может распространяться на трахею, гортань и носоглотку. Слизисто-гнойный экссудат резко нарушает функцию дыхательных путей; часто отмечается очаговый ателектаз и эмфизема, а также перибронхиальная инфильтрация воспалительными клетками, в частности лимфоцитами; возможно развитие бронхопневмонии.
В патогенезе коклюша участвуют входящие в состав поверхностного белкового токсина ГСФ (гистаминсенсибилизирующий фактор), ФСЛ (фактор, стимулирующий лимфоцитоз), БАО (белок, активирующий островки), а также характерное для него сходное с р-адреноблокаторами действие, адъювантный эффект и митогенность. На поверхности возбудителя имеется также термостабильный липополисахаридный эндотоксин, однако он, вероятно, не играет значительной роли в патогенезе этой инфекции. Кроме того, имеются другие биологически активные компоненты, включая цитоплазматический термолабильный токсин (ТЛТ), трахеальный цитотоксин (ТЦТ), внутриклеточную аденилатциклазу, нитевидный гемагглютинин (НГА) поверхности клетки, а также поверхностные агглютиногены. Капсула коклюшной палочки обладает антифагоцитарными свойствами. Антитела к капсульному антигену не обладают протективными свойствами.
Антикоклюшный секреторный IgA является протективным и специфически подавляет прилипание возбудителя к ресничкам мерцательного эпителия. Антитоксические антитела также обладают протективными свойствами, заключающимися в подавлении фиксации токсинов на рецепторных клетках или в нейтрализации токсинов. Роль клеточного Иммунитета при коклюше остается неясной.
Клинические проявления. После инкубационного периода продолжительностью 6—20 дней (в среднем 7 дней) появляются чиханье, умеренная лихорадка, ринорея, анорексия и слабый кашель (катаральная стадия), которые сохраняются в течение 1—2 нед, после чего частота и интенсивность кашля начинают усиливаться. В конце приступов кашля отмечается, особенно у детей раннего возраста, затяжное, часто мучительное затруднение вдоха. Кашель, приступы которого повторяются через различные интервалы времени (чаще через каждые несколько минут), длится в течение 2—4 нед (пароксизмальная стадия). У детей раннего возраста болезнь протекает намного тяжелее. Кашель препятствует приему пищи; слизь, выделяющаяся в процессе кашля, при ее проглатывании может.вызывать рвоту, что приводит к значительной дегидратации и потере массы тела. Кашель может привести к развитию венозного застоя, кровохарканью, носовому кровотечению и кровотечению из мелких сосудов. Гипоксия возникает значительно чаще и бывает намного глубже, чем это обычно отмечается клинически, что может являться причиной судорожных припадков, гипоксической энцефалопатии или комы. Роль токсина в развитии неврологических осложнений не изучена. У взрослых и детей старшего возраста заболевание протекает менее тяжело и сопровождается признаками выраженного, упорного бронхита. После пароксизмальной стадии наступает стадия выздоровления, которая продолжается от 1 до 6 нед; частота и интенсивность кашля уменьшаются, однако могут отмечаться и тяжелые приступы, особенно при вдыхании дыма и раздражающих веществ.
Самым частым осложнением при коклюше является пневмония, вызванная коклюшной палочкой или вторичными бактериальными агентами, и служащая причиной смерти более 90% детей в возрасте до 3 лет, погибших от этой инфекции. Закупорка слизью может привести к ателектазу; часто отмечается остановка дыхания. К числу других осложнений относят обострение латентного туберкулеза, средний отит (часто вызываемый пневмококками), субарахноидальное или внутрижелудочковое кровотечение, субдуральные гематомы, разрыв диафрагмы, пупочную или паховую грыжу, выпадение прямой кишки и менингоэнцефалит.
Диагноз. В основе клинического диагноза коклюша лежит наличие в анамнезе указаний на контакт с больным, классический кашель и выраженный абсолютный лимфоцитоз. Диагноз во многом зависит от идентификации коклюшной палочки в отделяемом со слизистой оболочки дыхательных путей. Успешному выделению возбудителя способствует немедленный посев материала из носоглотки в свежеприготовленную селективную среду. Поскольку характерные похожие на зерна жемчуга колонии формируются на 4—6-й день культивирования, к среде добавляют ингибиторы нормальной флоры носоглотки, например метициллин, чтобы не допустить подавления роста коклюшной палочки. Частота выделения возбудителя с помощью метода «кашлевых пластинок» слишком низка, чтобы рекомендовать его для широкого применения. Коклюшную палочку можно выделить в 90% случаев в период катаральной стадии болезни, но не более чем в 50% во время ее пароксизмальной стадии. С помощью метода флюоресцирующих антител возбудитель коклюша можно обнаружить в мазках из носоглотки, однако этот метод может дать до 40% ложноноложительных результатов, а также 10—
20% ложноотрицательных. Серологические исследования в целях диагностики не применяются. Посевы крови бывают стерильными, поэтому делать их не рекомендуют; на рентгенограммах грудной клетки можно увидеть утолщение пери-бронхиальных тканей, ателектазы или эмфизему, однако эти изменения неспецифичны. Встречаются случаи смешанной инфекции с аденовирусами, однако выделение вирусов не исключает при этом роли коклюшной палочки как основного этиологического фактора.
Иммуноферментный метод (EL1SA) может быть использован для обнаружения в сыворотке антител класса IgM, IgA и IgG, причем он достаточно эффективен для диагностики инфекции у больных с отрицательными результатами посевов. Этот метод можно также использовать для обнаружения IgA против возбудителя коклюша в носоглоточной слизи, начиная со 2—3-й недели заболевания и в течение по меньшей мере 3 мес. Выработка антител этого класса происходит при заражении коклюшем, но не при вакцинации. Коклюш следует дифференцировать от трахеобронхитов, вызванных вирусами, микоплазмами и другими бактериальными агентами, с учетом указаний на контакты с больными, характера и длительности клинических проявлений, а также результатов лабораторных исследований. При этом определяющее значение имеют положительные результаты бактериологических исследований.
Спазматический кашель может быть также связан с бронхиолитом; бактериальной, микоплазменной и вирусной пневмонией; кистозным фиброзом; инородными телами; заболеваниями, вызывающими компрессию дыхательных путей, такими как злокачественные опухоли или хронические обструктивные болезни легких. Указанные состояния можно дифференцировать на основании характерных для них клинических и лабораторных данных, а также их клинического течения.
Лечение. Общее поддерживающее лечение имеет решающее значение: тщательный уход за больным, устранение вызывающих приступы кашля факторов, кислород, отсасывание слизи из дыхательных путей, обеспечение потребностей в калориях и водно-электролитного баланса. Заслуживают внимания данные единственного контролируемого исследования о благоприятных результатах лечения стероидами тяжелых случаев коклюша у детей.
Возбудитель коклюша чувствителен ко многим антибиотикам in vitro. Антибиотики могут ликвидировать возбудителя и при назначении в катаральной стадии болезни предотвратить ее дальнейшее развитие. Поскольку к моменту появления приступов кашля патологический процесс разворачивается полностью, назначение антибиотиков в этот период не отражается на клиническом течении заболевания. Наиболее целесообразно применение эритромицина, который следует использовать также для предупреждения передачи инфекции. Эффективны также тетрациклин и левомицетин, однако использование их нежелательно ввиду потенциальной токсичности, особенно для детей. Ампициллин, по-видимому, относительно малоэффективен при ликвидации инфекции носоглотки. Лечение антибиотиками может уменьшить частоту и тяжесть вторичных бактериальных инфекций. Не рекомендуется назначение гипериммунной антибактериальной кроличьей сыворотки, поскольку она не влияет на продолжительность выделения бактерий или тяжесть клинических проявлений болезни.
Профилактика. Больных с подозрением на коклюш следует изолировать до тех пор, пока диагноз не будет опровергнут или инфекция не будет ликвидирована с помощью антибиотиков. Лиц, восприимчивых к инфекции и имевших контакты с больными, следует подвергнуть вакцинации (см. ниже) и лечению эритромицином в целях предупреждения развития заболевания и распространения инфекции.
В США до появления вакцины от коклюша погибало столько же детей, сколько от всех других инфекционных болезней вместе взятых. Для профилактики коклюша была разработана вакцина, основу которой составлял химический экстракт из бактериальной клетки. Учитывая высокий риск заражения коклюшем младенцев, было рекомендовано начинать иммунизацию как можно в более раннем возрасте. К сожалению, вакцинация детей в возрасте 7 дней вызывала слабый антительный ответ лишь у небольшого числа детей и приводила к слабому ответу на ревакцинацию в возрасте 12 мес. В настоящее время для удобства применения эту вакцину комбинируют с дифтерийным и столбнячным анатоксинами, при этом коклюшный компонент усиливает антительный ответ на анатоксины. В течение первых 6 лет жизни вакцину вводят 5 раз; причем первые три вакцинации проводят с интервалами в 2 мес, начиная с двухмесячного возраста ребенка.
Хотя вакцинация успешно предупреждала заболевание в 70—80% случаев у детей, имевших тесные контакты с больными, тем не менее стали возникать вопросы по ее эффективности и безопасности. Несмотря на получение полного курса профилактических прививок, ребенок может заболеть коклюшем, но заболевание у него будет протекать легче, чем у невакцинированных детей. Далее защищенность после вакцинации носит преходящий характер, и через 10 или более лет после последней прививки у ребенка остается лишь минимальная устойчивость к инфекции. Некоторые специалисты считают, что на самом деле резкое уменьшение заболеваемости коклюшем за последние десятилетия произошло благодаря улучшению жилищных и санитарных условий и питания. Однако имеющиеся данные свидетельствуют о том, что в США с началом вакцинации темпы снижения заболеваемости коклюшем ускорились. В пользу эффективности вакцинации убедительно говорит тот факт, что в Великобритании на фоне уменьшения числа специфических прививок возникла эпидемия коклюша.
Коклюшная вакцина вызывает местные реакции у реципиентов с частотой до 50%; редким, но реальным риском являются неврологические осложнения, включая неконтролируемые приступы плача, судороги и энцефалопатию. Вместе с тем положительный эффект вакцинации намного превышает риск развития серьезных неврологических осложнений. Появление у ребенка после введения вакцины судорог, нарушения сознания, шока, не прекращающейся в течение 3 ч и более плаксивости, пронзительных криков, очаговых неврологических знаков, повышение температуры тела до 40,5°С и более, а также анафилактических реакций служит противопоказанием для повторного ее введения. Не следует проводить вакцинацию детям, проживающим в США, при наличии у них в анамнезе сведений о судорожных припадках. У таких детей после введения коклюшной вакцины частота судорог может увеличиться. Нет каких-либо убедительных данных о том, что единичные судорожные припадки после вакцинации приводят к стойким поражениям нервной системы, либо усиливают имеющиеся неврологические нарушения. Повышенный риск развития судорог, возможно, имеется у детей с неврологическими нарушениями, связанными с наследственными заболеваниями. Вакцинация таких детей может быть на некоторое время отложена, однако этот вопрос должен решаться с учетом индивидуальных особенностей каждого больного; ситуацию следует оценивать при каждом очередном обращении к врачу.
Полагают, что недоношенность не увеличивает вероятность развития судорог после введения коклюшной вакцины. К группе повышенного риска развития судорог после введения коклюшной вакцины не относят детей с задержкой развития или с церебральным параличом. Поскольку частота токсических реакций увеличивается с возрастом, вакцину редко назначают детям старше 6 лет. Однако лицам старших возрастов с хроническими заболеваниями легких и больничному персоналу, имеющему контакты с больными, по-видимому, может быть рекомендовано введение абсорбированной коклюшной вакцины (в дозе 0,1—0,25 мл).
ГЛАВА 110. МЯГКИЙ ШАНКР
Аллан Р. Рональд, Фрэнсис А. Пламмер (Allan R. Ronald, Francis A. Plummer)
.Определение. Мягкий шанкр (венерическая язва)—острая передающаяся половым путем инфекция, характеризующаяся болезненными изъязвлениями половых органов, часто связанными с воспалительной аденопатией паховых лимфатических узлов. Последняя может прогрессировать вплоть до развития нагноения. Диагноз устанавливается на основании выделения возбудителя — Haemophilus ducreyi из очага поражения или нагноившегося лимфатического узла. при условии исключения сифилиса, полового герпеса и других специфических возбудителей изъязвления половых органов.
Этиология. Выделение Н. ducreyi из очагов поражения доказывает микробную этиологию мягкого шанкра. Часто обнаруживаются также грамположительные кокки и анаэробные грамотрицательные палочки. Однако не существует доказательств того, что именно эти микроорганизмы играют роль независимого возбудителя и требуют специфического лечения; клиническая эффективность антимикробной терапии коррелирует с лекарственной чувствительностью Н. ducreyi. В районах, где заболевание мягким шанкром широко распространено, Н. ducreyi в 90% случаев выделяют из язв, клинически подозрительных на это заболевание. Возбудитель представляет собой грамотрицательный факультативный аэроб, требующий для своего развития гемин (фактор X), но не нуждающийся в присутствии никотинамидадениндинуклеотида (фактор Y); многие штаммы нуждаются также в присутствии сыворотки. Хотя не существует какого-либо универсального биологического или иммунологического признака этого микроорганизма, морфология колоний Н. ducreyi весьма характерна: желто-серые колонии возбудителя легко и без повреждений снимаются с поверхности агара. Окрашенные по Граму некоторые штаммы представляют собой типичные стрептобациллярные «цепочки». Однако этот признак весьма вариабелен и не может использоваться как таксономический критерий.
Эпидемиология. Истинная частота заболеваемости мягким шанкром неизвестна, что обусловлено неточной диагностикой и неполной информацией. Заболевание широко распространено в юго-восточной Азии и Африке и во многих странах преобладает над сифилисом. В США ежегодно сообщается менее чем о 1000 заболеваний. Однако отмечаются локализованные вспышки: например, в 1981 и 1982 гг. в Южной Калифорнии наблюдались сотни заболеваний, преимущественно среди мигрирующих сезонных рабочих. Соотношение больных мужчин и женщин составляет в США 5:1. Мужчины, не подвергнувшиеся обрезанию, более чувствительны к заражению. Главную роль в распространении заболевания играет проституция, и среди моряков и военнослужащих, имеющих половые контакты преимущественно с проститутками, мягкий шанкр обнаруживается чаще, чем сифилис. Роль цервикального носительства Н. ducreyi в распространении инфекции неясна. В то же время известно, что более чем у половины вторичных половых партнеров мужчин, больных мягким шанкром, развиваются клинические проявления болезни. Доказательств бессимптомного носительства возбудителя без клинических проявлений заболевания не существует.
Клинические проявления. После инкубационного периода продолжительностью от 3 до 10 дней на месте внедрения инфекции появляется маленькая воспалительная папула, которая изъязвляется в течение 2—3 дней. Классическая характерная для мягкого шанкра язва (рис. 110-1), как правило, поверхностна, размеры ее варьируют от нескольких миллимегров до нескольких сантиметров в диаметре. Края неровные и подрытые, дно покрыто некротическим экссудатом. Язвы часто бывают множественными и могут сливаться, образуя гигантские, или ползучие, язвы. Иногда очаги поражения остаются пустулезными и напоминают фолликулиты или пиогенную инфекцию. В противоположность сифилису язвенные поражения при мягком шанкре у мужчин очень болезненны и не имеют плотной консистенции; наиболее часто язвы локализуются по краю крайней плоти, на ее
Рис. 110-1. Классический мягкий шанкр.
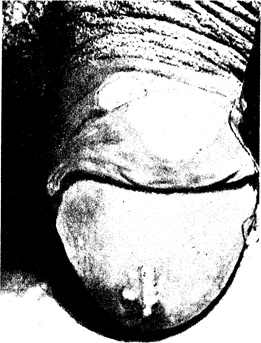
внутренней поверхности и на уздечке. У женщин поражаются половые губы, уздечка половых губ и перианальная область; очаги поражения более поверхностные и менее болезненные.
Почти у 50% больных развивается острая, болезненная воспалительная аденопатия паховых лимфатических узлов, чаще односторонняя, сопровождающаяся их уплотнением. Если своевременно не начать лечение, вовлеченные в процесс лимфатические узлы сливаются, формируя однофокусный гнойный бубон. Покрывающая его кожа натягивается, становится эритематозной и в конце концов прорывается, формируя глубокую одиночную язву.
Диагностика. Диагностика, основанная на оценке морфологии очагов поражения, расположенных на половых органах, чревата ошибками, и многие очаги, диагностируемые как проявления мягкого шанкра, на самом деле являются генитальными проявлениями герпеса или сифилиса. В одном проведенном в США исследовании из 100 последовательно включенных в него мужчин с наличием язвы на половом члене у 22 обнаружен генитальный гсрпес, у 17—сифилис, у 8— травматические очаги. Классические для мягкого шанкра язвы были отмечены у 12, но только у 2 из них из язв был выделен возбудитель. В другом исследовании у 2 больных с подозрением на паховую гранулему выделена культура Н. ducreyi. Эти поражения были определены как паховая гранулема мягкого шанкра. В противоположность этому в Кении из 97 мужчин с изъязвлением полового члена 60 были инфицированы Н. ducreyi, у 11 был диагностирован сифилис и только у 4 — генитальный гсрпес.
Первичная инфекция половых путей вирусом простого герпеса также вызывает болезненную паховую аденопатню, но может быть распознана по особенностям начала заболевания с везикулярных очагов или по наличию в анамнезе данных о возможном заражении вирусом герпеса и по присутствию системных симптомов, таких как лихорадка и миалгия. Мягкий шанкр системных симптомов, как правило, не вызывает.
Шанкр первичного сифилиса отличается плотной консистенцией, сопровождается двусторонней аденопатией, безболезненный, без нагноения. Для исключения сифилиса у всех больных, имеющих язвы на половых органах, необходимо произвести два последовательных (в разные дни) бактериоскопических исследования в темном поле отделяемого язв, а также троекратное (с интервалами в один месяц) серологическое исследование сыворотки крови на наличие антител к возбудителю сифилиса.
При венерической лимфогранулеме (LGV) в отличие от мягкого шанкра аденопатия развивается после заживления язвы. Она безболезненна, часто имеет двустороннюю локализацию и характеризуется многоочаговыми нагноениями и свищами.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 462; Нарушение авторских прав?; Мы поможем в написании вашей работы!