
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Острая дыхательная недостаточность
|
|
|
|
Несмотря на то что острая дыхательная недостаточность у больных с хроническими обструктивными заболеваниями легких характеризуется вполне определенными клиническими признаками, надежная диагностика этого патологического состояния основана на результатах исследования газового состава (Рао2„ Расо2) и рН крови, что позволяет дифференцировать острую дыхательную недостаточность от хронической. Поскольку у большинства больных наблюдается хроническая гипоксемия и гиперкапния, диагноз острой дыхательной недостаточности устанавливают с учетом степени прогрессирования снижения Рао2 и повышения Расо2 в каждом конкретном случае. Так, если у пациента значения Рао2 составляют более 70 мм рт. ст., то резкое падение этого показателя ниже 60 мм рт. ст. указывает на острую дыхательную недостаточность. Иными словами, если хроническая гипоксемия достаточно быстро усугубляется (на 10—15 мм рт. ст.), то это является надежным доказательством острой дыхательной недостаточности.
Поскольку почечные компенсаторные механизмы в условиях хронической гиперкапнии определяют близкие к нормальным значения рН крови, то резкое повышение Расо2 приводит к развитию метаболического ацидоза. С практической точки зрения важным представляется то, что выраженная гиперкапния, ассоциирующаяся со снижением рН до 7,3 и менее, указывает на развитие острой дыхательной недостаточности.
Предрасполагающие факторы. Увеличение количества бронхиального секрета, повышение его вязкости, как правило, вследствие присоединения бронхолегочной инфекции являются наиболее частыми причинами развития острой дыхательной недостаточности у больных с хроническими обструктивными заболеваниями легких. Повышение бронхиального сопротивления вследствие воспалительного отека слизистой оболочки бронхов и гиперсекреции лежит в основе усугубления гипоксемии и гиперкапнии. Возбуждение, бессонница, учащенное дыхание у больных с хроническими обуструктивными заболеваниями легких нередко служат основанием для безусловно ошибочного назначения в данной клинической ситуации транквилизаторов и/или наркотических средств, способных усугубить вентиляционные расстройства вплоть до развития острой дыхательной недостаточности. В этой связи, очевидно, что медикаментозные средства, угнетающие дыхание, категорически не рекомендуется назначать больным с обструктивными заболеваниями легких, осложненными явлениями дыхательной недостаточности. Имеются многочисленные свидетельства того, что атмосферные поллютанты также нередко усугубляют вентиляционные нарушения. Поэтому больные с хроническим бронхитом и эмфиземой легких должны по возможности избегать контактов с профессиональными и бытовыми атмосферными выбросами.
Нередко причиной острой дыхательной недостаточности служат пневмония, тромбоэмболия ветвей легочной артерии, левожелудочковая недостаточность, пневмоторакс. Ургентный характер данной клинической ситуации затрудняет установление конкретной причины бурного прогрессирования вентиляционных нарушений. В этом случае наряду с оценкой газового состава крови необходимо провести рентгенографию органов грудной клетки, электрокардиографию и исследовать мокроту.
Лечение больных с дыхательной недостаточностью. Лечение больных с дыхательной недостаточностью осуществляют одновременно по двум направлениям:
1) поддержание оптимального уровня вентиляции крови и оксигенации крови;
2) лечение бронхолегочной инфекции, восстановление бронхиального дренажа и улучшение проходимости воздухоносных путей.
В первую очередь в случае выраженной гипоксии и возможности угнетения дыхания из-за ослабления гипоксической стимуляции дыхательного центра необходимо провести кислородотерапию. Ингаляции кислорода обычно осуществляют в концентрациях, достаточных для поддержания Рао2 на уровне 55— 60 мм рт. ст.; при этом необходимо тщательное мониторирование Расо2„ рН крови и клинического состояния больного.
Предпочтительнее начинать лечение с небольшого повышения Fio2 до 0,24 (для сравнения в атмосферном воздухе Fio2 составляет 0,21), используя для этого носовую канюлю (скорость подачи кислорода 1—2 л/мин) или, что лучше, маску Вентури (Venturi) 0,24. Эта носоротовая маска функционирует на основе принципа Бернулли, осуществляя подачу фиксированной концентрации О2, прямо пропорциональной скорости объемного воздушного потока. При этом разработаны и применяются маски для более высоких концентраций кислорода — Fio2 составляет 0,28, 0,35 и 0,40. Даже небольшое повышение Рао2 приводит к значительному возрастанию содержания кислорода в артериальной крови (см. гл. 283). У некоторых пациентов по мере улучшения оксигенации крови одновременно повышается Расо2.. Это объясняют тем, что в условиях кислородотерапии происходит усугубление гиповентиляции. Вероятно, этот механизм лежит в основе ухудшения вентиляционно-перфузионных взаимоотношений в условиях ингаляции кислорода (гл. 200). В подобной ситуации наилучшим представляется минимально возможное повышение Fio2, дающей возможность поддерживать Рао2 на уровне 50—60 мм рт. ст. Незначительное повышение Fio2 на фоне ингаляции кислорода, как уже говорилось выше, вполне ожидаемо и, как правило, не представляет реальной угрозы для жизни больного.
Однако если гиперкапния становится более выраженной, то могут развиться ступор или даже кома. Это объясняется СО2-индуцируемой дилатацией сосудов мозга с повышением внутричерепного давления, отеком соска зрительного нерва. Следует особо подчеркнуть, что в случае развития гиперкапнической комы ни в коем случае не следует прекращать проводимую кислородотерапию. Дело в том, что при критическом повышении Расо2 происходит дальнейшее угнетение активности дыхательного центра и пациент становится более уязвимым в отношении гипоксии; при этом развиваются генерализованные судороги, фатальные желудочковые аритмии. В подобной ситуации единственно правильным способом лечения является интубация трахеи и проведение поддерживающей механической вентиляции легких (см. гл. 216).
Следует особо подчеркнуть, что объем вдыхаемой воздушной смеси и частота дыханий должны быть рассчитаны таким образом, чтобы удалось снизить Расог до «привычного» (хронически повышенного) уровня, не стремясь к более значительному его снижению или нормализации. Поскольку в условиях длительно существующей гиперкапнии в процесс компенсации включаются почечные механизмы, то, очевидно, резкое снижение Расог приведет к появлению выраженного алкалоза, который в свою очередь может вызвать угрожающие жизни больного тахиаритмии и генерализованные судороги.
Наряду с проведением кислородотерапии необходимо улучшить дренажную функцию бронхов, назначать бронхолитики и антибактериальные препараты. Улучшение бронхиального дренажа достигается стимуляцией кашлевого рефлекса и/или путем аспирации секрета через эндотрахеальный катетер. Показано также применение муколитических средств. Помимо этого, b2-агонисты наряду с бронходилатацией вызывают улучшение мукоцилиарного клиренса. Также можно применять постуральный дренаж и перкуссионный массаж грудной клетки, особенно при выраженной бронхиальной секреции, что сопровождается улучшением трахеобронхиального клиренса, отхождением большего количества мокроты и уменьшением обструкции воздухоносных путей.
Особая роль в терапии острой дыхательной недостаточности при хронических обструктивных заболеваниях легких принадлежит бронхолитикам — аминофиллину (перорально или внутривенно капельно) и b2-агонистам (ингаляционно или подкожно). Помимо собственно бронходилатирующего действия, эти препараты улучшают бронхиальный клиренс, обладают диуретическим эффектом, положительно влияют на состояние центральной гемодинамики при развитии легочного сердца и правожелудочковой недостаточности (см. гл. 191). Если нет клинико-рентгенологических признаков острой пневмонии, то вопрос о назначении антибиотиков решается с большей осторожностью, чем в случаях гнойного (слизисто-гнойного) воспаления при отсутствии дыхательной недостаточности. Тем не менее, если антибиотики назначают, то при обнаружении легионелл или микоплазмы предпочтение отдают эритромицину, если же микробный агент не удается идентифицировать, то назначают антибиотики широкого спектра действия.
Осложнения, возникающие в процессе лечения острой дыхательной недостаточности, включают сердечные аритмии (прежде всего политопная суправентрикулярная тахикардия), левожелудочковую недостаточность, тромбоэмбо лию ветвей легочной артерии и желудочно-кишечные кровотечения на почве стрессовой ульцерации слизистой оболочки желудка. Нарушения сердечного ритма связывают с резким падением Раог или повышением рН. Однако, когда больные в рамках проводимого лечения получают и препараты, обладающие потенциальным кардиотоксическим действием, трудно исключить ятрогенное происхождение аритмий. Поддержание сывороточной концентрации теофиллина на уровне 10—20 мг/л и использование селективных b2-агонистов сводят возможность развития подобных ятрогенных расстройств к минимуму.
Левожелудочковую недостаточность, обычно осложняющую течение инфаркта миокарда, артериальной гипертензии или аортального порока сердца, достаточно сложно диагностировать у больных с клиническими проявлениями легочного сердца. Здесь важно помнить, что улучшение вентиляции легких и оксигенации крови сопровождается обратным развитием легочной гипертензии и правожелудочковой недостаточности (см. гл. 191), увеличением диуреза. Если же признаки застойной сердечной недостаточности на фоне адекватно проводимой кислородотерапии сохраняются или прогрессируют, то это скорее всего связано с доминирующей левожелудочковой декомпенсацией. В данной ситуации целесообразно провести эхокардиографию или радиовентрикулографию, поскольку физикальное и рентгенологическое обследования характеризуются минимальной диагностической ценностью. И только при достижении оптимального газового состава крови и наличии безусловных признаков левожелудочковой недостаточности можно назначать сердечные гликозиды. В случае застоя в малом круге кровообращения столь же эффективны и диуретики. Однако следует помнить, что активная диуретическая терапия может осложняться гипокалиемией, гипохлоремическим метаболическим алкалозом и, как следствие этого, угнетением дыхательного центра.
Тромбоэмболию легочной артерии, нередко развивающуюся у больных с острой дыхательной недостаточностью, диагностировать достаточно сложно, поскольку у данной категории пациентов изменения на перфузионной сканограмме носят малоспецифический характер, а проявления легочного сердца соответствуют выраженности вентиляционных расстройств. В этой связи считается оправданным профилактическое назначение низких доз гепарина.
Желудочно-кишечные кровотечения вследствие стрессовой ульцерации слизистой оболочки желудка нередко осложняют течение острой дыхательной недостаточности. Использование антацидов, назогастральная аспирация и/или применение циметидина существенно уменьшают частоту данного осложнения.
У пациентов, находящихся на искусственной вентиляции легких, вопрос о переходе к спонтанному дыханию решается в значительной степени эмпирически. Критериями прекращения искусственной вентиляции легких являются улучшение газового состава крови и функции легких. Более точными показателями перехода от механического к спонтанному дыханию служат: возможность развития максимального давления при произвольном дыхании через рот более 20 см вод. ст., жизненная емкость легких более 10 мл/кг массы тела, дыхательный объем более 5 мл/кг массы тела. Однако следует заметить, что у многих пациентов искусственную вентиляцию легких прекращают еще до достижения этих параметров.
После прекращения искусственной вентиляции легких не всегда удается поддерживать напряжение газов крови на оптимальном уровне. Во-первых, это можно объяснить продолжающимся приемом седативных препаратов, назначенных ранее в связи с возбужденным состоянием пациента. Очевидно, что в этом случае препараты следует отменить; при этом надо учитывать время их метаболизации в организме. Во-вторых, просвет эндотрахеальной трубки оказался слишком малым, что требует замены на трубку с большим диаметром. В-третьих, можно предполагать усугубление бронхиальной обструкции и мукоидную закупорку бронхов. В-четвертых, следует иметь в виду и возможность развития метаболического алкалоза (связанного или не связанного с приемом диуретиков); в этом случае показано применение хлорида калия. В-пятых, в процессе проведения искусственной вентиляции легких Рао2 и Расо2 не удавалось поддерживать на оптимальном уровне. Этого можно избежать, если незадолго до предполагаемого прекращения аппаратного дыхания использовать Fio„ позволяющую поддерживать Рао2 на уровне 60 мм рт. ст., и относительно небольшие объемы вдуваемой газовой смеси, «фиксирующие» исходный уровень Paco2 (при нормальных или умеренно сниженных значениях рН крови). В-шестых, недостаточное питание, гипокалиемия или нервно-мышечные заболевания могут привести к повышенной утомляемости дыхательной мускулатуры и сделать спонтанное дыхание неэффективным. При этом особое клиническое значение придается слабости диафрагмы. С практической точки зрения ключом к установлению данного клинического феномена является обнаружение парадоксального движения передней брюшной стенки в период вдоха.
Экспериментальными исследованиями установлено, что аминофиллин в терапевтических концентрациях обусловливает обратное развитие слабости дыхательной мускулатуры, однако вопрос о влиянии дыхательных стимуляторов на мышечный тонус до настоящего времени остается неясным.
Пациентам с выраженной слабостью дыхательного центра и нарушениями вентиляционной функции легких метилксантины следует назначать с осторожностью. Если у больного выявляется метаболический ацидоз, то в качестве дыхательного аналептика целесообразно использовать ацетазоламид (диакарб), одновременно восполняя дефицит хлоридов. Медроксипрогестерон — дыхательный аналептик центрального действия, или алмитрин, оказывающий стимулирующее влияние на периферические хеморецепторы, в настоящее время признаются наиболее безопасными препаратами для применения у пациентов данной категории.
Гипотиреоидизм—патологическое состояние, характеризующееся известными нервно-мышечными расстройствами, представляет серьезную диагностическую проблему у больных с острой дыхательной недостаточностью. В этой связи длительно текущие вентиляционные нарушения диктуют необходимость целенаправленного исследования функционального состояния щитовидной железы.
Прогноз. Согласно многочисленным популяционным исследованиям у больных с хроническими обструктивными заболеваниями легких вентиляционная функция медленно, но неуклонно снижается. В целом, вероятность развития острой дыхательной недостаточности резко возрастает при снижении ОФВ1 ниже 25% от нормальных величин. Хотя внутригоспитальная летальность при первом эпизоде острой дыхательной недостаточности достигает 30%, а 5-летняя выживаемость с момента ее клинического проявления составляет лишь 15—20%, в каждом конкретном случае довольно сложно определить как ближайший, так и отдаленный прогноз. Можно лишь отметить, что у больных с преобладанием эмфиземы прогноз в целом менее благоприятный, чем у больных с преобладанием бронхита. Но во всех случаях при развитии выраженной гипоксемии проведение длительной кислородотерапии характеризуется увеличением продолжительности и улучшением качества жизни.
Буллезная эмфизема легких. Сливающиеся друг с другом воздухосодержащие пространства, диаметр которых превышает 1 см, иногда могут быть врожденными, но чаще наблюдаются у больных эмфиземой и диффузным фиброзом легких. Постепенно эти воздушные полости (буллы) увеличиваются в размерах, что обусловлено тракционными усилиями со стороны участков легочной ткани с сохраненной эластической тягой; эти участки по мере прогрессирующего увеличения размеров буллезных образований уменьшаются в размерах. В тех случаях, когда отмечается быстрое и значительное увеличение булл, а результаты перфузионного и вентиляционного сканирования свидетельствуют о сохранном состоянии небуллезных участков легких, показана резекция воздухосодержащей полости. Впрочем, в большинстве случаев вскоре после проведенного оперативного вмешательства в ранее интактных отделах легких формируются новые буллезные образования.
Варианты эмфиземы легких. Наряду с центр- и панацинарной формами (вариантами) эмфиземы легких существуют и другие морфологические типы этой патологии, имеющие, впрочем, существенно меньшее клиническое значение. Иногда вследствие перерастяжения и разрыва межальвеолярных перегородок в участках легких, окружающих очаги пневмофиброза, формируется так называемая рубцовая эмфизема; эмфизема может распространяться вдоль анатомических границ ацинусов (парасептальная эмфизема). Последняя форма, локализующаяся нередко субплеврально, может осложняться рецидивирующим спонтанным пневмотораксом (см. гл. 214).
В редких случаях у новорожденных развивается врожденная долевая эм физема (в основе ее лежит клапанный механизм с поражением соответствующего долевого бронха), характеризующаяся прогрессирующим течением и представляющая реальную угрозу для жизни.
Эмфизему, поражающую одно легкое (синдромы MacLeod, Swyer—James), как правило, выявляют при рентгенографии органов грудной клетки. Поскольку при этой форме эмфиземы воздухоносные пути остаются интактными, но сокращается число функционирующих альвеол, то заболевание может быть распознано уже в детском возрасте (как известно, в нормальных условиях увеличение числа альвеол происходит именно в 7—8-летнем возрасте). При патологоанатомических исследованиях у больных с односторонней эмфиземой не удается обнаружить нарушения целостности межальвеолярных перегородок — классического признака эмфиземы легких. Нередко односторонняя эмфизема ассоциируется с гипоплазией легочной артерии на стороне поражения. В случаях, когда заболевание осложняется присоединением рецидивирующей бронхолегочной инфекции, встает вопрос о резекции пораженного легкого.
Прочие диффузные бронхообструктивные синдромы. «Облитерирующий бронхиолит» — термин, предложенный для обозначения заболевания, характеризующегося распространенным воспалительным процессом и фиброзом воздухоносных путей малого калибра. Первоначально этот синдром регистрировали у лиц, перенесших в детском возрасте тяжелую вирусную респираторную инфекцию (как правило, парагрипп). Однако в последние годы сходные морфологические изменения в легких стали описывать и у пациентов среднего и пожилого возраста, страдающих ревматоидным артритом. Заболевание характеризуется минимальным «ответом» на проводимую бронхолитическую терапию и большинство больных погибают вследствие прогрессирующей дыхательной недостаточности в течение ближайших двух лет с момента клинического проявления легочного синдрома. Имеются отдельные указания на возможную связь этого своеобразного бронхолегочного поражения с приемом пеницилламина больными ревматоидным артритом, однако эта патогенетическая концепция не в состоянии объяснить происхождение отдельных случаев облитерирующего бронхиолита у лиц, никогда не принимавших этот препарат.
Сходные с облитерирующим бронхиолитом гистопатологические изменения в легких обнаруживают у реципиентов аутологичного донорского костного мозга. И хотя у пациентов данной категории наиболее частыми осложнениями со стороны органов дыхания являются интерстициальная пневмония и легочный фиброз, в отдельных наблюдениях удается выявить типичную картину облитерирующего бронхиолита. Характерно, что эта своеобразная бронхолегочная патология чаще развивается у больных с синдромом «трансплантат против хозяина», хотя отсутствие последнего и не исключает возможности возникновения облитерирующего бронхиолита.
Лимфангиолейомиоматоз — редко встречающееся заболевание, диагностируемое, как правило, у женщин молодого возраста. Характеризуется пролиферацией гладкомышечных клеток в стенках лимфатических сосудов грудной и брюшной полости. Клинически заболевание проявляется рецидивирующим хилотораксом (пневмотораксом), обструктивными вентиляционными нарушениями и скиалогической картиной легочной диссеминации. Современными исследователями показана возможность предотвращения (удаление яичников, длительный прием прогестерона) прогрессирования этого в принципе неизлечимого заболевания.
Муковисцидоз у взрослых больных с развитием хронического бронхообструктивного синдрома обсуждался ранее (гл. 207).
ГЛАВА 209. ИНТЕРСТИЦИАЛЬНЫЕ ЗАБОЛЕВАНИЯ ЛЕГКИХ
Рональд Дж. Кристал (Ronald G. Cristal)
Интерстициальные заболевания легких (ИЗЛ) — хронические незлокачественные, неинфекционные заболевания, характеризующиеся воспалением и дезорганизацией стенок альвеол. Наиболее закономерный и серьезный исход данной патологии — это уменьшение числа функционирующих альвеолярно-капиллярных комплексов и, как следствие этого, нарушение оксигенации крови. Характерным клиническим проявлением ИЗЛ является одышка, особенно при физических усилиях, существенно ограничивающая двигательную активность пациентов. Если заболевание, описываемое в рамках ИЗЛ, прогрессирует, то причиной смерти чаще всего служит дыхательная недостаточность.
ИЗЛ получили свое название потому, что для всех объединяемых этим термином заболеваний типичны той или иной степени повреждения и дезорганизация соединительнотканного матрикса альвеолярной стенки. Поскольку морфологически данная патология характеризуется также пневмофиброзом, то нередко используют и термин «фибротические заболевания легких». Учитывая тот факт, что при описании рентгенограмм органов грудной клетки участки воспаления и фиброза легочной ткани могут быть оценены как «инфильтрация», ИЗЛ иногда группируют наряду с инфекционными и неопластическими заболеваниями в рубрике «диффузные инфильтративные заболевания легких». Меньшее распространение имеют такие термины, как «интерстициальная пневмония» или «хронический пневмонит».
Перечень заболеваний, входящих в рубрику ИЗЛ, насчитывает около 180 наименований. Традиционно ИЗЛ подразделяют на болезни с известной и неизвестной этиологией (табл. 209-1 и 209-2 соответственно). Однако, несмотря на этиологические различия, все заболевания характеризуются общностью морфологических, функциональных и клинических проявлений. Настоящая глава посвящена преимущественно интерстициальным болезням легких неизвестной этиологии.
Нормальная анатомия (рис. 209-1). ИЗЛ неизвестной этиологии характеризуются вовлечением в патологический процесс альвеол, альвеолярных ходов, терминальных бронхиол, а также легочных артерий и вен мелкого калибра. Результатом этого является уменьшение числа функционирующих альвеол и, как следствие, развитие дыхательной недостаточности.
В норме легкие взрослого человека содержат около 30•106 альвеол. Диаметр альвеол составляет 200—300 мкм, а толщина их стенок— 5—10 мкм. Суммарная площадь внутренней поверхности альвеол составляет около 150 м2; через эту гигантскую поверхность и осуществляется газообмен между альвеолярным воздухом и легочными капиллярами (в каждый отдельно взятый момент времени в легочных капиллярах содержится до 200 мл крови). Легочные капилляры и альвеолы настолько тесно прилежат друг к другу, что расстояние между воздухом и кровью составляет всего 0,6—0,8 мкм.
Таблица 209-1. Известные причины интерстициальных заболеваний легких
Вдыхание различных веществ из окружающей атмосферы (гл. 203 и 204): неорганическая пыль (пневмокониозы); органическая пыль (гиперсенситивные пневмониты или экзогенные аллергические альвеолиты); газы; дымы; пары; аэрозоли
Лекарственные вещества (гл. 65)
Вторичные, на фоне переносимых инфекционных воспалительных заболеваний легких
Радиационные воздействия Яды (гл. 171)
Как стадия выздоровления после респираторного дистресс-синдрома взрослых (гл. 216)
Альвеолярную стенку составляют четыре основных типа клеток: эпителиальные клетки I и II типов, эндотелиальные и мезенхимальные клетки. Эпителиальные клетки I типа, формирующие покровный плоский эпителий, напоминают по форме жареное яйцо и выстилают до 95% всей внутренней поверхности альвеол. Эпителиальные клетки II типа, имеющие кубическую форму, ответственны за выработку сурфактанта — липопротеида, поверхностно-активного вещества, секретируемого особыми пластинчатыми структурами цитоплазмы. Сурфактант секретируется внутрь альвеол и, уменьшая поверхностное натяжение, придает стабильность респираторным отделам легких. Соединение между отдельными эпителиальными клетками достаточно прочно, чтобы препятствовать поступлению жидкой части крови внутрь альвеол при повышении проницаемости легочных капилляров. Клетки I и II типов образуют своеобразный эпителиальный пласт, «покоящийся» на базальной мембране, толщина которой составляет 0,1 мкм. Эндотелиальные клетки, выстилающие внутреннюю поверхность легочных капилляров, по своим характеристикам не отличаются от эндотелиальных клеток любой другой локализации. Эндотелиальные клетки также располагаются на базальной мембране толщиной 0,1 мкм; в тех местах, где эндотелиальные и эпителиальные клетки тесно прилежат друг к другу, базальная мембрана значительно истончается.
Мезенхимальные клетки представлены в основном фибробластами, а также миофибробластами, гладкомышечными клетками и перицитами. Последние продуцируют основное вещество соединительнотканного матрикса альвеолярной стенки.
Соединительная ткань альвеолярной стенки обозначается термином «интерстиций» и представлена эпителиальной и эндотелиальной базальными мембранами и заключенным между ними соединительнотканным матриксом. Соединительнотканный матрикс состоит преимущественно из коллагена I типа (в минимальной степени присутствует и коллаген III типа), фибриногена, эластических волокон и протеогликанов. Эти макромолекулярные соединения осуществляют механическую «поддержку» альвеолярной стенки и придают упругость дистальным отделам респираторного тракта.
Патологические изменения паренхимы легких (рис. 209-2).
Различные по степени выраженности морфологические изменения при любой из форм ИЗЛ включают интерстициальное и/или внутриальвеолярное воспаление, характеризующееся уменьшением числа легочных капилляров, повреждением альвеолярных эпителиальных клеток и фиброзом альвеолярной стенки.
При некоторых заболеваниях, например при саркоидозе, когда повреждение легочной ткани обычно выражено в минимальной степени, регресс патологического процесса сопровождается восстановлением нормальной архитектоники дистальных отделов респираторного тракта. При идиопатическом легочном фиброзе, напротив, паренхиматозное повреждение выражено в значительно большей степени и приобретает стойкий характер. Если зоны поражения достаточно обширны, то нарушается нормальная архитектоника респираторных отделов легких, формируются участки массивного пневмофиброза и кистозная трансформация легких. Очевидно, что подобные участки легочной ткани уже не способны осуществлять адекватный газообмен.
Таблица 209-2. Интерстициальные заболевания легких неизвестной этиологии
Саркоидоз (гл. 270) Идиопатический легочный фиброз
ИЗЛ, ассоциированные с диффузными заболеваниями соединительной ткани: ревматоидный артрит (гл. 263) склеродермия (гл. 264) системная красная волчанка (гл. 262) полимиозит — дерматомиозит (гл. 356) синдром Шегрена (гл. 266)
Гистиоцитоз Х
Хроническая эозинофильная пневмония Идиопатический легочный гемосидероз Синдром Гудпасчера (гл. 224) Гиперэозинофильный синдром Иммунобластная лимфаденопатия
Недифференцируемые лимфопролиферативные заболевания: лимфатическая интерстициальная пневмония псевдолимфома
Лимфангиомиоматоз Амилоидоз (гл. 259) Альвеолярный протеиноз Бронхоцентрический гранулёматоз
Наследственные заболевания: семейный легочный фиброз бугорчатый склероз нейрофиброматоз (гл. 351) синдром Херманского — Пудлака болезнь Нимана — Пика (гл. 316) болезнь Гоше (гл. 316)
ИЗЛ, ассоциированные с заболеваниями печени: хронический активный гепатит (гл. 248) первичный билиарный цирроз печени (гл. 249)
ИЗЛ, ассоциированные с заболеваниями кишечника: болезнь Уипла (гл. 237) неспецифический язвенный колит (гл. 238) болезнь Крона (гл. 238) болезнь Вебера — Крисчена (гл. 318)
ИЗЛ, ассоциированные с легочными васкулитами: гранулёматоз Вегенера (гл. 272) лимфоматоидный гранулёматоз синдром Черджа — Строе (гл. 269) системный некротизирующий васкулит (гл. 269) гиперсенситивный васкулит (гл. 269)
ИЗЛ, ассоциированные с хроническими заболеваниями сердца: левожелудочковая недостаточность, шунт «слева направо»
ИЗЛ, ассоциированные с хронической почечной недостаточностью
ИЗЛ, ассоциированные с реакцией «трансплантат против хозяина» (гл. 291)
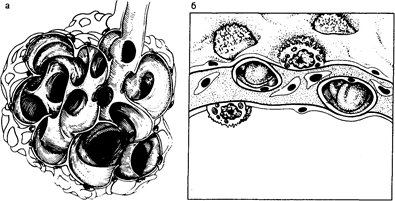
Рис. 209-1. Нормальная анатомия дистальных отделов дыхательных путей. а — схематическое изображение терминальных бронхиол, открывающихся в просвет альвеол; б — схематическое изображение среза альвеолярной стенки. Изображены плоские эпителиальные клетки I типа, кубические эпителиальные клетки II типа, эндотелиальные, мезенхимальные клетки и соединительная ткань интерстиция.
Степень поражения эпителиальных клеток обусловлена формой и выраженностью соответствующего заболевания. Наиболее характерным при этом является уменьшение числа альвеолоцитов I типа, замена их на кубические альвеолоциты II типа, а также миграция клеток слизистой оболочки бронхов в направлении терминальных бронхиол. Редукция капиллярного русла малого круга кровообращения приводит к развитию легочной гипертензии.
Альвеолярная стенка может быть утолщена в несколько раз. В результате этого расстояние между альвеолярным воздухом и кровью увеличивается, уменьшаются внутриальвеолярные пространства и нарушаются упруго-эластические свойства легочной паренхимы. Иногда утолщение альвеолярной стенки обусловлено ее отеком. Однако значительно чаще развивается фиброз — резко увеличивается число мезенхимальных элементов и происходит новообразование отдельных компонентов соединительной ткани, прежде всего коллагена I типа. Реже фибротические процессы ограничиваются исключительно интерстициальной тканью.
Описана также своеобразная форма так называемого внутриальвеолярного фиброза, когда новообразующаяся соединительная ткань, разрушая эпителиальную базальную мембрану, распространяется внутрь просвета альвеол и приводит к утолщению их стенок.
Патогенез. Дезорганизация альвеолярной архитектоники — характерный признак большинства форм ИЗЛ, — обусловлена хроническим воспалением дистальных отделов респираторного тракта. В случаях ИЗЛ установленной этиологии хронический воспалительный процесс индуцируется известными агентами. При этом (например, при лекарственно-зависимой патологии легких) причинные факторы, обладая цитотоксическим эффектом, оказывают непосредственное повреждающее действие на легочную ткань. Среди ИЗЛ неизвестной этиологии воспаление играет меньшую роль, и в основе повреждения и дезорганизации легочной ткани лежат патологическая пролиферация мезенхимальных клеток (например, при лимфангиолейомиоматозе) либо отложение депозитов внеклеточного материала, в норме отсутствующего в респираторных отделах легких (например, при альвеолярном протеинозе).
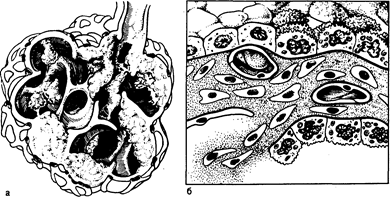
Рис. 209-2. Патологические изменения легочной паренхимы при ИЗЛ. а — схематически изображены утолщенные стенки альвеол, внутриальвеолярный фиброз, а также зоны, где альвеолярный фиброз «имплантируется» в альвеолярную стенку; б — схематически изображена метаплазия эпителиальных клеток I типа в эпителиальные клетки II типа (клетки с микроворсинками) и бронхиолярные клетки (клетки кубической формы). В просвете одного из капилляров изображены пролиферирующие фибробласты; стенка альвеолы фиброзирована и утолщена. Базальная мембрана также утолщена, в одном месте нарушена ее целостность и через этот дефект во внутриальвеолярное пространство проникают клеточные элементы интерстиция.
Различают два основных механизма повреждающего действия клеток воспаления на альвеолы. Первый заключается в том, что клетки воспаления аккумулируются на ограниченных участках альвеолярной стенки, а это приводит к ее повреждению и нарушениям процесса газообмена. Второй предполагает выделение воспалительными клетками большого числа медиаторов, повреждающих клетки паренхимы и соединительнотканный матрикс, стимулирующих пролиферацию фибробластов, что и приводит к формированию легочного фиброза (рис. 209-3).
В норме в одной альвеоле содержится около 60 альвеолярных макрофагов и 15 лимфоцитов, тогда как полиморфно-клеточные лейкоциты, как правило, не обнаруживаются. При развитии же воспаления (в случае интерстициальных заболеваний легких неясной этиологии) происходят следующие морфологические изменения: 1) значительно увеличивается число клеток воспаления в респираторных отделах легких; 2) изменяется соотношение воспалительных клеточных элементов — для одних заболеваний характерно преобладание лимфоцитов, в других случаях доминируют нейтрофилы, альвеолярные макрофаги и/или эозинофилы; 3) повышается функциональная активность клеток воспаления. Последние активируются под воздействием целого ряда медиаторов, которые в свою очередь оказывают повреждающее действие на альвеолярные структуры. Так, некоторые медиаторы инициируют процесс образования токсичных кислородных радикалов, которые вызывают повреждение клеток паренхимы; высвобождающиеся при этом внутриклеточные протеазы обусловливают дезорганизацию соединительнотканного матрикса легких.
Легочный фиброз развивается вследствие высвобождения альвеолярными макрофагами медиаторных субстанций, инициирующих пролиферацию фибробластов. Эти медиаторы, включая фибронектин и ростовой фактор альвеолярных макрофагов, способствуют перемещению фибробластов в интерстиций. В результате резко увеличивается число фибробластов, «продуцирующих» соединительную ткань, что и приводит к формированию пневмофиброза.
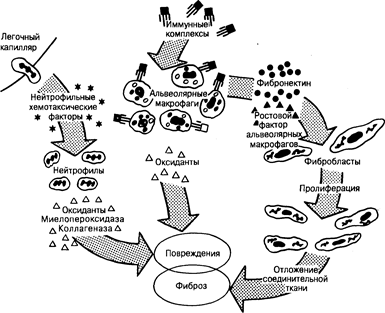
Рис. 209-3. Схема патогенеза идиопатического легочного фиброза, одной из ведущих форм в рубрике ИЗЛ неизвестной этиологии.
Хотя представленные механизмы и являются достаточно специфичными для идиопатического легочного фиброза, последний может рассматриваться в качестве своеобразного образца развития и прогрессирования легочного фиброза для всей группы ИЗЛ в целом. Обозначения: AMDGF — ростовой фактор альвеолярных макрофагов.
При некоторых заболеваниях, относимых в рубрику ИЗЛ, в патологический процесс вовлекаются также мелкие легочные артерии и вены. При этом в редких случаях проявления легочного васкулита оказываются доминирующими, преобладая над менее выраженными паренхиматозными изменениями. Иногда воспалительный процесс ограничивается терминальными бронхиолами, что препятствует движению воздуха к соответствующим альвеолам; с другой стороны, для отдельных форм ИЗЛ характерно поражение висцеральной плевры с развитием плеврального выпота.
Патофизиология. Основным итогом развития ИЗЛ являются нарушения обмена кислорода между альвеолярным воздухом и кровью. Существуют два механизма развития гипоксемии. Во-первых, часть альвеол вентилируется недостаточно для того, чтобы поддерживать адекватное парциальное напряжение О2 в капиллярной крови. Во-вторых, вследствие утолщения альвеолярной стенки резко нарушается диффузия О2. Когда указанные патологические феномены сочетаются с редукцией капиллярного русла легких, то компенсаторно возрастает насосная функция правого сердца. В данной ситуации скорость кровотока через интактные или малоизмененные капилляры возрастает и время контакта эритроцитов с альвеолярным воздухом оказывается недостаточным для оптимального насыщения гемоглобина кислородом. Возникающая вследствие этих процессов гипоксемия, как правило, в условиях покоя выражена в минимальной степени, но резко возрастает при физических усилиях.
В противоположность закономерно обнаруживаемым у большинства больных с ИЗЛ изменениям альвеолярно-капиллярного транспорта кислорода Расо2 у них оказывается изначально сниженным вследствие рефлекторной гипервентиляции. Последняя объясняется стимулирующим влиянием гипоксемии на каротидные хеморецепторы, а также раздражением афферентных нервных волокон вследствие повреждения легочной паренхимы.
Уменьшение числа функционирующих легочных капилляров приводит к возрастанию гемодинамической нагрузки на правый желудочек сердца; при этом увеличение сердечного выброса сопряжено с повышением давления в малом круге кровообращения. Однако этот компенсаторный механизм имеет свои ограничения; по мере прогрессирования легочного процесса даже возросшие показатели сердечного выброса уже не в состоянии обеспечить адекватный газообмен. В этой связи прогредиентное течение ИЗЛ закономерно сопровождается развитием правожелудочковой декомпенсации.
Клинические проявления. Несмотря на многообразие отдельных форм ИЗЛ, все они характеризуются поражением респираторных отделов легких и, как следствие этого, проявляются сходными клиническими симптомами.
Жалобы. Как правило, пациенты, страдающие ИЗЛ, обращаются за медицинской помощью лишь тогда, когда их легкие уже не в состоянии обеспечить адекватное насыщение организма кислородом при физической нагрузке. В этот период наблюдается достаточно характерный симптомокомплекс — слабость, повышенная утомляемость, одышка при повседневной двигательной активности. Другие общие симптомы (лихорадка, анорексия, снижение массы тела) нехарактерны. Обычно больных беспокоит непродуктивный кашель, гораздо реже — дискомфорт и боли в грудной клетке, кровохарканье.
Физикальные признаки. Самым характерным акустическим признаком ИЗЛ являются сухие трескучие хрипы, лучше выслушиваемые в базальных отделах легких в конце глубокого вдоха. Такие симптомы, как локальные свистящие хрипы, шум трения плевры, встречаются реже. При умеренном или выраженном прогрессировании ИЗЛ обнаруживаются признаки легочной гипертензии (см. гл. 191 и 210). Утолщение ногтевых фаланг пальцев кистей или, иногда, стоп в виде «барабанных палочек» наблюдается на поздних стадиях заболевания, однако синдром гипертрофической легочной остеоартропатии встречается крайне редко.
Анализы крови и мочи. За исключением известных изменений газового состава артериальной крови, ИЗЛ, как правило, не характеризуются какими-либо определенными изменениями состава крови и мочи. СОЭ несколько увеличена. Несмотря на имеющуюся гипоксемию, полицитемия обнаруживается достаточно редко. У 5—10% больных в сыворотке крови выявляют ревматоидный фактор, антинуклеарные антитела и др. Нередка гиперглобулинемия.
Рентгенография органов грудной клетки. У 90% больных на прямой и боковой рентгенограммах органов грудной клетки видны изменения в легких. В типичных случаях это ретикулярная, нодулярная или ретикуло-нодулярная диссеминация. На ранних стадиях патологического процесса можно обнаружить ацинарные тенеобразования, носящие распространенный характер, но, как правило, тяготеющие к нижним и средним отделам легких. Небольших размеров кистозные полости (так называемая картина «сотового легкого») типичны для поздних стадий ИЗЛ. Несмотря на перечисленные классические рентгенологические признаки ИЗЛ, интактная рентгенограмма органов грудной клетки не отвергает возможности существования одной из форм этих заболеваний. В то же время рентгенологически определяемые патологические изменения в легких еще не являются доказательством связанных с болезнью органов дыхания нарушений газового состава крови.
Функциональные легочные тесты. Для ИЗЛ характерны рестриктивные нарушения функции внешнего дыхания, проявляющиеся снижением легочных объемов (жизненная емкость легких, общая емкость легких) при нормальном или умеренно повышенном отношении объема форсированного выдоха за 1-ю секунду к форсированной жизненной емкости легких (офв1/фжел). Отличают и снижение диффузионной способности легких, обусловленное уменьшением числа функционирующих альвеол и редукцией капиллярного русла. При изучении газового состава артериальной крови выявляют умеренную гипоксемию, значительно усугубляющуюся при физической нагрузке; рН обычно в пределах нормы, однако при максимальной нагрузке и неадекватной оксигенации может развиться метаболический ацидоз. Исследования эластических свойств легочной ткани, хотя и редко проводимые в клинической практике, демонстрируют феномен «жесткого» легкого, т. е. максимально возможное увеличение легочных объемов в данной ситуации достигается за счет возрастания транспульмонального давления.
Сцинтиграфические исследования. Проведение перфузионного (с использованием макроагрегатов альбумина, меченных 99Те) и вентиляционного (133Хе) сканирования легких дает возможность выявить «пятнистый» характер поражения, отражающий вовлечение в патологический процесс альвеол и мелких бронхов. Радиоизотопное исследование с 67Ga демонстрирует диффузный характер поглощения радиофармпрепарата легочной паренхимой.
Бронхоальвеолярный лава ж. Характер воспаления при ИЗЛ находит свое отражение в том или ином представительстве клеточных элементов, обнаруживаемых в жидкости бронхоальвеолярного лаважа. При этом преобладают альвеолярные макрофаги, лимфоциты, нейтрофильные и ацидофильные гранулоциты либо клетки воспаления в различных сочетаниях. При ИЗЛ, вызванных ингаляцией неорганических пылей, в бронхоальвеолярных смывах могут быть обнаружены частички соответствующей пыли.
Прочие исследования. На ЭКГ обычно регистрируются неспецифические изменения, однако с развитием легочной гипертензии обнаруживаются соответствующие признаки, указывающие на гемодинамическую перегрузку и гипертрофию правых отделов сердца.
При катетеризации правых отделов сердца, редко проводимой в подобных клинических ситуациях, отмечают легочную гипертензию, нормальное давление «заклинивания» в легочной артерии, а на поздних стадиях патологического процесса — повышение конечно-диастолического давления в полости правого желудочка. Несмотря на ограниченные компенсаторные возможности правого желудочка, правосердечная декомпенсация развивается относительно редко.
Диагностическое обследование. Прежде всего необходимо изучить истории болезни, провести физикальное обследование пациента, рентгенографию органов грудной клетки в прямой и боковых проекциях, исследовать функции внешнего дыхания, включая определение жизненной и общей емкости легких, диффузионной способности, офв1/фжел и показателей газового состава крови в условиях относительного покоя. В целом полученной информации достаточно для диагностики диффузного поражения легочной ткани. Возраст больного играет важное значение при рассмотрении вопроса об альтернативном диагнозе. Так, например, у 25-летней женщины, страдающей одышкой, с рентгенологической картиной ретикуло-нодулярной диссеминации и медиастинальной лимфаденопатией наиболее вероятно предположение о саркоидозе. Тогда как у 60-летнего пациента со сходными клинико-рентгенологическими проявлениями прежде всего требует исключения диагноз злокачественного новообразования.
Больного следует подробно расспросить о возможно имевшей место ингаляции неорганической или органической пыли, паров, газов, аэрозолей, а также приеме лекарственных препаратов, поскольку это может подтвердить или исключить известные причины развития ИЗЛ. Анализы крови не имеют какой-либо диагностической ценности. Нередко значительные трудности возникают при попытке дифференцировать ИЗЛ от прочих интерстициальных легочных процессов, включая застойную сердечную недостаточность (гл. 182), широкий спект злокачественных (гл. 213) и инфекционных заболеваний легких (гл. 205 и 206).
Фибробронхоскопия скорее помогает исключить диагноз опухолевого или инфекционного заболевания, а изучение цитограммы жидкости бронхоальвеолярного лаважа лишь детализирует характер воспалительного процесса. Хотя сканирование легких с использованием 67Ga и позволяет судить об активности легочного воспаления, тем не менее эта методика не имеет сколько-нибудь существенного диагностического значения. В случаях ИЗЛ известной этиологии биопсию легких не проводят, поскольку достаточно установить причинно-следственную связь между этиологическим агентом и легочным поражением. С другой стороны, у отдельных больных с ИЗЛ неясной этиологии (см. ниже) специфические гистологические находки позволяют установить нозологический диагноз. При необходимости морфологической диагностики легочного процесса предпочтение, как правило, отдается открытой биопсии легкого (исключение составляет саркоидоз, при котором оправдано проведение трансторакальной биопсии).
Стадии течения патологического процесса. Существует два подхода в оценке стадийности течения ИЗЛ, основанных на анализе выраженности патологических изменений в легочной ткани и определении активности воспалительного процесса. Анализ выраженности патологических изменений в легких строится с учетом анамнестических сведений, данных физикального обследования, результатов лабораторных и функциональных методов исследования. Подобным же образом можно оценить и активность воспалительного процесса. Однако в последнем случае данные функционального и рентгенологического обследования имеют весьма ограниченное значение. В этой связи наилучшим методом считают открытую биопсию легкого; но проводят ее у конкретного больного, как правило, только один раз. Поскольку патологический процесс при большинстве ИЗЛ ограничен респираторными отделами легких, то в большинстве случаев не удается выявить каких-либо изменений состава крови. В пульмонологических центрах дополнительную информацию о выраженности и характере воспаления у больных ИЗЛ получают при сканировании легких с 67Ga и изучении цитограммы бронхоальвеолярного лаважа.
Лечение. При лечении больных ИЗЛ известной этиологии прежде всего необходимо исключить дальнейший контакт пациента с токсичным агентом. Исключая пневмокониозы, которые не имеют какого-либо специфического лечения, в большинстве случаев ИЗЛ известной и неизвестной этиологии используют препараты, подавляющие течение воспалительного процесса в респираторных отделах легких. Здесь речь прежде всего идет о глюкокортикоидах, назначаемых перорально в исходно высокой дозе (обычно преднизолон из расчета 1 мг/кг в сутки) в течение 4—6 нед с последующим постепенным переходом на поддерживающие дозировки (0,25 мг/кг преднизолона в сутки); если же на фоне гормональной терапии наблюдается отчетливый клинико-рентгенологический регресс, то ее отменяют полностью. Другой препарат, характеризующийся выраженной противовоспалительной и иммуносупрессивной активностью — циклофосфан, — назначают лишь по строгим показаниям (см. ниже).
Больным с синдромом обратимой бронхиальной обструкции назначают бронходилататоры. На поздних стадиях ИЗЛ, когда Рао, в состоянии относительного покоя снижается менее 55—50 мм рт. ст., показана заместительная кислородотерапия. При этом в большинстве случаев удается восстановить нормальное парциальное давление кислорода в артериальной крови. Важно подчеркнуть, что длительная кислородотерапия, как правило, не сопровождается развитием гиперкапнии.
Осложнения. Течение отдельных форм ИЗЛ очень разнообразно. В ряде случаев патологический процесс неуклонно прогрессирует и заканчивается фатально; в других — болезнь приобретает волнообразное или стабильное течение. Основные осложнения ИЗЛ патогенетически связаны с недостаточной оксигенацией жизненно важных органов и включают острое нарушение мозгового кровообращения, аритмии и инфаркт миокарда. На поздних стадиях заболевания нередко присоединение респираторной инфекции. Несмотря на то что большинство больных получают глюкокортикоиды, оппортунистические микроорганизмы относительно редко служат причиной бронхолегочного воспаления.
Интерстициальные заболевания легких известной этиологии. В целом ИЗЛ известной этиологии составляют около 1/3 всех случаев интерстициальных заболеваний легких.- Наиболее широко среди них представлены пневмопатии, обусловленные ингаляцией органических или неорганических пылей, а также приемом различных лекарственных препаратов (см. табл. 209-1).
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 613; Нарушение авторских прав?; Мы поможем в написании вашей работы!