
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гиперфункция коры надпочечников 1 страница
|
|
|
|
При секреции избыточных количеств основных гормонов коры надпочечников возникают четкие клинические синдромы. Так, избыточная продукция кортизола приводит к развитию синдрома Кушинга, избыточная продукция альдостерона — клинических и биохимических признаков альдостеронизма, а избыточная продукция андрогенов —к вирилизму надпочечникового генеза. Эти синдромы не всегда встречаются в «чистом» виде, и их проявления могут суммироваться.
Синдром Кушинга. Этиология. Синдром Кушинга характеризуется ожирением туловища, гипертензией, утомляемостью и слабостью, аменореей, гирсутизмом, фиолетовыми стриями на животе, отеками, глюкозурией, остеопорозом и базофильной опухолью гипофиза. Современная классификация синдрома Кушинга приведена в табл. 325-3. Независимо от причины, его вызывающей, синдром Кушинга всегда обусловливается усиленной продукцией кортизола надпочечниками. В большинстве случаев имеет место двусторонняя гиперплазия надпочечников, вызванная стимуляцией коркового слоя этих желез вследствие гиперсекреции гипофизарного АКТГ или продукции АКТГ опухолями других тканей. Частота гипофиззависимой гиперплазии надпочечников у женщин втрое выше, чем у мужчин, причем наиболее часто заболевание начинается на третьем-четвертом десятилетии жизни. Причина гиперсекреции АКТГ гипофизом все еще остается неясной, но, по всей вероятности, первичное нарушение локализуется в гипоталамусе или высших нервных центрах, что обусловливает секрецию КРГ в количествах, не соответствующих уровню кортизола в крови. Поэтому, чтобы снизить секрецию АКТГ до нормы, необходим более высокий уровень кортизола. Этот первичный дефект приводит к гиперстимуляции гипофиза и в некоторых случаях к образованию опухоли в нем. По мере роста опухоли гипофиза она может стать независимой от регуляторных влияний факторов центральной нервной системы и/или уровня кортизола в крови. Таким образом, у лиц с гиперсекрецией гипофизарного АКТГ может иметь место микроаденома (менее 10 мм) или макроаденома (более 10 мм) гипофиза либо диффузная гиперплазия кортикотропных клеток (гипоталамо-гипофизарная дисфункция). Поскольку микроаденомы гипофиза нередко трудно обнаружить обычными рентгенологическими способами, неизвестно, насколько часто аденомы служат причиной синдрома Кушинга. По традиции диагноз болезни Кушинга ставят только больным с АКТГ-продуцирующей опухолью гипофиза. Однако в ряде клинических центров этот диагноз устанавливают всем больным с гиперсекрецией гипофизарного АКТГ независимо от наличия у них опухоли. В данной главе мы пользуемся традиционным определением.
Опухоли неэндокринных тканей могут секретировать полипептиды, которые своими биологическими, химическими и иммунными свойствами не отличаются от АКТГ или КРГ и способны вызывать двустороннюю гиперплазию надпочечников (см. также гл. 303). Эктопическая продукция КРГ приводит к развитию клинических, биохимических и рентгенологических признаков, неотличимых от тех, которые вызываются гиперсекрецией гипофизарного АКТГ. При эктопической продукции АКТГ часто, но не всегда отсутствуют типичные признаки и симптомы синдрома Кушинга, а на первый план выступают гипокалиемический алкалоз и нарушение толерантности к глюкозе. В большинстве таких случаев речь идет о недифференцированном мелкоклеточном (овсяноклеточном) бронхогенном раке или об опухолях тимуса, поджелудочной железы или яичников, медуллярном раке щитовидной железы или бронхиальных аденомах. Синдром Кушинга, особенно у больных с овсяноклеточным раком легких, может возникать внезапно, и это отчасти объясняет отсутствие в таких случаях классических внешних признаков. С другой стороны, у больных с карциноидными опухолями или феохромоцитомами клиническая картина развивается в течение более длительного времени, и у них обычно имеются типичные кушингоидные черты. Секреция АКТГ опухолями неэндокринных тканей сопровождается накоплением в плазме фрагментов и предшественников этого гормона. Поскольку такие опухоли могут продуцировать большие количества АКТГ, базальная экскреция стероидов с мочой значительно возрастает и отмечается усиленная пигментация кожи. Действительно, гиперпигментация у больных с синдромом Кушинга почти всегда указывает на вненадпочечниковую опухоль, располагающуюся либо внутри, либо вне полости черепа.
Таблица 325-3. Причины синдрома Кушинга
I. Гиперплазия надпочечников
Вторичная по отношению к гиперпродукции АКТГ Гипофизарно-гипоталамическая дисфункция АКТГ-продуцирующие микро- или макроаденомы гипофиза Вторичная по отношению к АКТГ- или КРГ-продуцирующим опухолям неэндокринных тканей (бронхогенный рак, карциноид тимуса, рак поджелудочной железы, аденома бронхов)
II. Узелковая гиперплазия надпочечников
III. Новообразования надпочечников Аденома Рак
IV. Экзогенные, ятрогенные причины
Длительное применение глюкокортикоидов Длительное применение АКТГ
Приблизительно у 20—25% больных с синдромом Кушинга имеется первичная гиперпродукция кортизола и других стероидов, обусловленная надпочечниковым новообразованием. Эти опухоли развиваются обычно лишь на одной из сторон, и примерно половина из них — злокачественные. Иногда у больных выявляются биохимические признаки как гиперсекреции гипофизарного АКТГ, так и аденомы надпочечников. В таких случаях обнаруживаются обычно микро- или макроузелковые изменения в обоих надпочечниках, определяющие узелковую гиперплазию.
Наиболее частая причина синдрома Кушинга — это ятрогенное введение стероидов по другим поводам. Хотя клиническая картина синдрома в этих случаях имеет некоторое сходство с таковой у лиц, страдающих аденомой надпочечников, анамнез и первые лабораторные исследования позволяют без труда выделить таких больных.
Клинические признаки, симптомы и лабораторные да иные. О многих признаках и симптомах синдрома Кушинга можно догадаться, исходя из знаний эффектов глюкокортикоидов (табл. 325-4). Вследствие мобилизации периферических опорных тканей возникают мышечная слабость и утомляемость, остеопороз, кожные стрии и кровоподтеки. Два последних признака обусловливаются слабостью и разрывами коллагеновых волокон в коже. Остеопороз может быть настолько выраженным, что приводит к компрессии тел позвонков и переломам других костей. В результате усиления гликонеогенеза в печени и инсулинорезистентности нарушается толерантность к глюкозе. Явный диабет встречается менее чем у 20% больных, у которых, вероятно, имеется семейная предрасположенность к этому заболеванию. Избыток кортизола способствует отложению жировой ткани в характерных местах, особенно в верхней части лица (классическое лунообразное лицо), в межлопаточной области («бычий горб»), а также в мезентериальном ложе, что определяет классическое «туловищное» ожирение (рис. 325-6). Изредка жировые отложения появляются над грудиной, и из-за накопления жира увеличивается медиастинальное пространство. Причины такого своеобразного распределения жировой ткани неясны. Лицо кажется полнокровным, даже если концентрация эритроцитов не повышена. Часто встречаются гипертензия, а также глубокие эмоциональные нарушения — от раздражимости или эмоциональной неустойчивости до тяжелой депрессии, помешательства или даже явных психозов. У женщин повышенная секреция надпочечниковых андрогенов может вызывать образование угрей, гирсутизм и олиго- или аменорею. Наиболее частые признаки и симптомы у больных с гиперкортицизмом, такие как ожирение, гипертензия, остеопороз и диабет, достаточно неспецифичны и поэтому мало помогают диагностике данного заболевания. С другой стороны, легкая травмируемость, типичные стрии, миопатия и андрогенные эффекты (встречающиеся, однако, реже), если они присутствуют, служат более надежными признаками синдрома Кушинга.
За исключением случаев ятрогенного синдрома Кушинга содержание кортизола в плазме и 17-гидроксикортикоидов в моче при этом заболевании в той или иной степени повы-
Таблица 325-4. Частота признаков и симптомов при синдроме Кушинга (%)
| Типичный внешний вид | Аменорея | ||
| Увеличение массы тела | Кожные стрии | ||
| Утомляемость и слабость | Изменения личности | ||
| Гипертензия (более 150/90 мм рт. ст | Экхимозы | ||
| Гирсутизм | Отеки | ||
| Полиурия, полидипсия | |||
| Гипертрофия клитора |
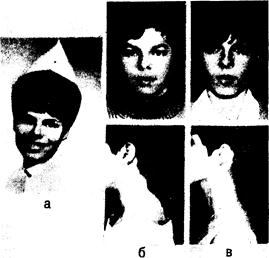
Рис. 325-6. Женщина в возрасте 20 лет с синдромом Кушинга на почве аденомы коры правого надпочечника. а — за 2 года до операции (в возрасте 18 лет); б — за 1 мес до операции (в возрасте 20 лет); в — через 1 год после операции (в возрасте 21 года).
шено. Иногда имеют место гипокалиемия, гипохлоремия и метаболический алкалоз, особенно у больных с эктопической продукцией АКТГ.
Диагностика. Диагноз синдрома Кушинга ставят тем больным, у которых повышена продукция кортизола, и невозможно нормально подавить его секрецию при введении дексаметазона. После установления диагноза проводят пробы, позволяющие выяснить этиологию избытка кортизола (рис. 325-7 и табл. 325-5).
Для первоначального скрининга рекомендуется ночной супрессивный тест с дексаметазоном (см. выше). В сложных случаях (например, при ожирении) в качестве скрининг-теста прибегают также к определению суточной экскреции свободного кортизола. Экскреция выше 100 мкг в сутки говорит в пользу синдрома Кушинга. Затем, если после стандартного «малого» супрессивного теста с дексаметазоном (0,5 мг каждые 6 ч в течение 48 ч) уровень кортизола в моче не падает ниже 30 мкг в сутки, содержание кортизола в плазме — ниже 5 мкг/дл (50 мкг/л) или экскреция 17-гидроксистероидов — ниже 3 мг/24 ч, устанавливают окончательный диагноз. Разобщенное определение уровней кортизола, а также АКТГ в плазме крови малоинформативно из-за их суточных колебаний, хотя данные об отсутствии нормального их снижения перед сном имеют определенную пользу.
Выяснение причины синдрома Кушинга затруднено неспецифичностью всех существующих тестов, а также спонтанными изменениями секреции гормонов, часто весьма резкими, которые могут возникать при вызывающих этот синдром опухолях (периодический гормоногенез). Специфичность ни одного из тестов не превышает 95%, и для установления правильного диагноза может потребоваться сочетание нескольких тестов. На первом этапе особенно целесообразно оценить реакцию экскреции кортизола на введение большой дозы дексаметазона (2 мг каждые 6 ч в течение 2 дней). Результаты большинства исследований свидетельствуют о том, что более чем у половины больных при проведении этого теста содержание кортизола и/или 17-гидроксистероидов в моче падает ниже 50% от исходного уровня. У таких больных обычно имеется либо АКТГ-секретирующая микроаденома гипофиза, либо гипоталамо-гипофизарная дисфункция. Иногда выведение стероидов резко падает и у больных с двусторонней узелковой гиперплазией надпочечников и/ или эктопической продукцией КРГ. Отсутствие выраженного снижения продукции кортизола после введения малых или больших доз дексаметазона характерно обычно для больных с гиперплазией надпочечников, обусловленной АКТГ-секретирующей макроаденомой гипофиза или АКТГ-продуцирующей опухолью неэндокринного происхождения, а также для больных с опухолями надпочечников (см. табл. 325-5).
Теоретически для разграничения различных причин синдрома Кушинга, особенно для АКТГ-зависимых и АКТГ-независимых его форм, полезно было бы определять уровень АКТГ в плазме крови. При АКТГ-независимых формах это, как правило, так и есть, поскольку большинство опухолей надпочечников характеризуется низким или даже неопределимым уровнем АКТГ. Более того, АКТГ-секретирующие макроаденомы гипофиза и АКТГ-продуцирующие неэндокринные опухоли обычно характеризуются повышенными уровнями АКТГ. Однако ориентироваться на уровень АКТГ в дифференциальной диагностике синдрома Кушинга мешают по меньшей мере два обстоятельства. Во-первых, надежные методы определения АКТГ до сих пор еще доступны не повсеместно, а во-вторых, у больных с гипоталамо-гипофизарной дисфункцией, микроаденомой гипофиза, эктопической продукцией КРГ и продукцией АКТГ некоторыми неэндокринными опухолями (особенно карциноидными) уровни АКТГ могут быть близкими по значению (см. табл. 325-5).
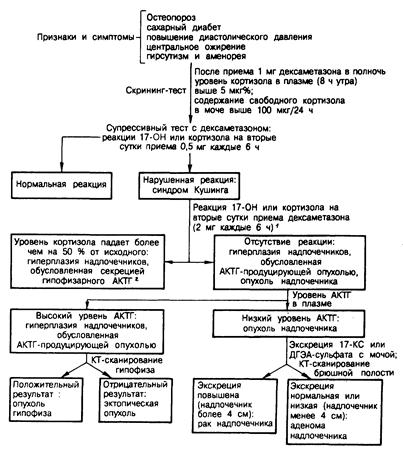
Рис. 325-7. Диагностическая схема, применяемая при обследовании больных с подозрением на синдром Кушинга.
1 Вместо «большого» дексаметазонового теста (2 мг внутрь каждые 6 ч) можно оценивать реакцию 17-гидроксикортикостероидов на метопирон (750 мг внутрь каждые 4 ч, 6 доз). У большинства больных с гиперплазией надпочечников, обусловленной гиперсекрецией гипофизарного АКТГ, экскреция 17- гид-роксикортикостероидов с мочой после приема метопирона повышается; отсутствие реакции указывает на новообразование надпочечников или их гиперплазию, обусловленную АКТГ-продуцирующей опухолью неэндокринной ткани.
2 Эта группа включает, вероятно, больных как с гипоталамо-гипофизарной дисфункцией, так и с микроаденомами гипофиза. В некоторых случаях микроаденому гипофиза удается визуализовать с помощью КТ-сканирования турецкого седла.
Эти трудности заставляют применять некоторые дополнительные тесты, например пробы с введением метопирона и КРГ. Оба они имеют сходное теоретическое обоснова
Таблица 325-5. Диагностические тесты для определения типа синдрома Кушинга
| Показатель | Макроаденома гипофиза | Гипоталамо-гипофизарная дисфункция или микроаденома | Эктопическая продукция АКТГ или КРГ | Опухоль надпочечника |
| Уровень АКТГ в плазме | — | Н— | . — | ¯ |
| Реакции на высокую дозу дексаметазона, % | <10 | >80 | <10 | <10 |
| Реакция на метопирон,% | >80 | >90 | <10 | <10 |
| Реакция на КРГ, % | >90 | >90 | <10 | <10 |
Обозначения:Н — норма, — повышение, ¯. — снижение.
ние: гиперсекреция стероидов, обусловленная опухолью надпочечников или эктопической секрецией АКТГ, должна подавлять гипоталамо-гипофизарную ось, и в результате с помощью каждого из этих тестов можно выявить ингибирование гипофизарной секреции АКТГ. Действительно, большинство больных с гипоталамо-гипофизарной дисфункцией и/или микроаденомой гипофиза реагируют на введение метопирона и КРГ повышением секреции стероидов или АКТГ, тогда как у большинства больных с эктопическими АКТГ-продуцирующими опухолями и опухолями надпочечников этого не происходит. Реакция на КРГ отмечается и у большинства пациентов с макроаденомами гипофиза, но реакция на метопирон у них непостоянна. Однако целесообразность проведения инфузионного теста с КРГ остается неясной, поскольку он при менялся лишь в ограниченном числе исследований.
Главная проблема, возникающая при диагностике синдрома Кушинга, заключается в том, чтобы разграничить больных с микроаденомой гипофиза, эктопической продукцией КРГ, эктопической продукцией АКТГ некоторыми параэндокринными опухолями (например, карциноидами или феохромоцитомой) и гипофизарной дисфункцией гипоталамического генеза. В большинстве всех этих случаев на КТ-сканограмме гипофиза не обнаруживают какой-либо патологии. Сходны и клинические проявления, если только эктопические опухоли не вызывают других симптомов, таких как понос и приливы к лицу при карциноидных опухолях или приступы гипертонии при феохромоцитоме. Иногда, как отмечалось выше, эктопическую продукцию АКТГ удается отличить от гипофизарной с помощью тестов с метопироном или КРГ. В некоторых клиниках для того, чтобы убедиться, что источник гиперпродукции АКТГ локализуется именно в гипофизе, определяют разницу концентраций АКТГ в крови каменистой пазухи и периферической крови. Особенно трудно разграничить гипоталамо-гипофизарную дисфункцию и опухоли, продуцирующие КРГ; если эктопическая опухоль не видна или если она не продуцирует других гормонов, то надежных способов дифференциации нет.
Диагноз кортизолпродуцирующей аденомы надпочечника предполагают на основании непропорционального повышения фоновой экскреции 17-гидроксистероидов или свободного кортизола с мочой и лишь небольших колебаний уровня 17-кетостероидов в моче или ДГЭА-сульфата в плазме крови. У таких больных секреция андрогенов надпочечниками обычно снижена, поскольку избыток кортизола подавляет секрецию АКТГ с последующей инволюцией вырабатывающей андрогены сетчатой зоны.
Диагноз рака надпочечников предполагают при наличии в брюшной полости пальпируемой опухоли и значительного повышения фоновых уровней как 17-гидроксистероидов в моче, так и ДГЭА-сульфата в плазме. Содержание кортизола в плазме и моче в той или иной степени повышено. Рак надпочечников обычно резистентен и к стимуляции АКТГ, и к ингибированию дексаметазоном. У женщин выраженное повышение секреции надпочечниковых андрогенов часто вызывает вирилизацию. Феминизирующая эстрогенпродуцирующая карцинома коры надпочечников у мужчин обычно проявляется гинекомастией. Эти надпочечниковые опухоли секретируют чрезмерные количества андростендиона, который на периферии превращается в эстрогены — эстрон и эстрадиол (см. гл. 332). Функционирующие раки надпочечников, вызывающие синдром Кушинга, чаще всего характеризуются повышенными уровнями промежуточных продуктов биосинтеза стероидов (особенно 11-дезоксикортизола), что указывает на недостаточность превращения интермедиатов в конечный продукт. Важно также помнить, что в 20% случаев раки надпочечников не сопровождаются эндокринными синдромами и, как считают, либо являются нефункционирующими, либо продуцируют биологически неактивные стероидные предшественники. Наконец, в некоторых условиях чрезмерная продукция половых стероидов остается нераспознанной (например, избыточная секреция андрогенов у взрослых мужчин).
Дифференциальная диагностик а. Псевдосиндром Кушинга. Диагностические трудности возникают при обследовании больных с ожирением, хроническим алкоголизмом, психической депрессией и острой патологией любого типа. Резкое ожирение при синдроме Кушинга встречается редко; более того, при экзогенном ожирении жировая ткань распределяется относительно равномерно, а не локализуется только на туловище. При исследовании функции коры надпочечников у больных с экзогенным ожирением обычно выявляются лишь небольшие нарушения. Фоновая экскреция стероидов с мочой у пациентов с избыточной массой тела либо нормальна, либо слегка повышена; аналогичные данные имеются и о секреции кортизола. У некоторых больных ускоряется превращение секретируемого кортизола в экскретируемые метаболиты. Уровень кортизола в моче и крови остается нормальным; не нарушается и суточный ритм его уровня в крови и моче. Экзогенное ожирение может быть причиной изменений секреции и метаболизма стероидов; это подчеркивает вторичность возможных нарушений стероидных тестов. У лиц, страдающих хроническим алкоголизмом и депрессией, имеются сходные сдвиги в выведении стероидов: повышение уровня 17-гидроксистероидов в моче, отсутствие суточного ритма концентраций кортизола и резистентность к ингибирующему эффекту дексаметазона (особенно при ночном и малом тесте). В отличие от страдающих алкоголизмом у больных с психической депрессией признаки синдрома Кушинга отсутствуют. После отказа от алкоголя и/или улучшения эмоционального состояния результаты стероидных тестов нормализуются. У таких больных в отличие от лиц с синдромом Кушинга сохранена нормальная реакция кортизола на инсулиновую гипогликемию. У лиц с острыми заболеваниями при лабораторных исследованиях часто выявляют нарушения, и, кроме того, отсутствует подавление дексаметазоном, поскольку тяжелый стресс (такой как боль или лихорадка) отрицательно влияет на нормальную регуляцию секреции АКТГ. Внешние признаки ятрогенного синдрома Кушинга, вызванного введением сильных синтетических глюкокортикоидов, сходны с таковыми при эндогенной гиперфункции коры надпочечников. Выделить таких больных можно, лишь определив уровень кортизола в крови и моче или фоновую экскрецию 17-гидроксистероидов; все эти показатели снижены из-за ингибирования гипофизарно-надпочечниковой оси. Степень тяжести ятрогенного синдрома Кушинга определяется общей дозой вводимых стероидов, биологическим периодом полураспада стероидного препарата и продолжительностью его введения. Улиц, получающих стероиды во второй половине дня или вечером, синдром Кушинга развивается быстрее и при меньших суточных дозах экзогенных препаратов, чем у больных, стероидная терапия которых ограничена только утренними дозами. Разные больные характеризуются также неодинаковой активностью ферментов деградации введенных стероидов и их связывания.
Лучевые исследования при синдроме Кушинга. Лучшим рентгенологическим способом визуализации надпочечников является компьютерная томография (КТ-сканирование) области живота (рис. 325-8). Эта методика во многом вытеснила ранее применявшиеся инвазивные приемы (такие как селективная артериография и венография надпочечников), а также сканирование с 19-[131I]-йодхолестерином; с помощью КТ-сканирования удается не только определить локализацию опухоли надпочечников, но и отличить их от двусторонней гиперплазии. У всех больных с подозрением на гиперсекрецию гипофизарного АКТГ следует проводить КТ-сканирование гипофиза с контрастным средством, чтобы подтвердить наличие опухоли гипофиза. Однако даже с помощью лучших из существующих в настоящее время компьютерных томографов не всегда можно обнаружить небольшие микроаденомы.
Исследование бессимптомных новообразований в надпочечниках. При КТ-сканировании области живота часто случайно обнаруживают надпочечниковые новообразования. Это и неудивительно, так как аденомы коры надпочечни
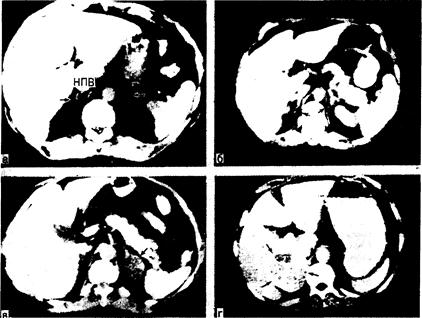
Рис. 325-8. Компьютерная томография—лучший метод визуализации надпочечников (надпочечники показаны стрелками). а — нормальный правый надпочечник прилежит к нижней полой вене (НПВ) у мести ее отхождения от печени. Примерно в 90% случаев правый надпочечник выглядит как линейная структура, тянущаяся кзади от нижней полой вены в пространство между правой долей печени и ножкой диафрагмы. Нормальный левый надпочечник лежит латерально от левой ножки диафрагмы и ниже желудка. Левый надпочечник в большинстве случаев по форме напоминает перевернутые буквы «V» или «Y»; б — КТ-сканограмма надпочечников у больного с эктопической продукцией АКТГ. Оба надпочечника (стрелки) увеличены по сравнению с изображенными на снимке а. В отличие от этого увеличение надпочечников при КТ-сканировании выявляется лишь у 50% больных с двусторонней гиперплазией этих желез, обусловленной гиперсекрецией гипофизарного АКТГ; в — КТ-сканограмма больного с синдромом Кушинга и биохимическими признаками гиперпродукции только кортизола. Левый надпочечник замещен опухолью диаметром 2 см, по форме напоминающей ракетку (стрелка). Опухоль плохо контрастируется, так как содержит много липидов; г — КТ-сканограмма больного с синдромом Кушинга и биохимическими признаками рака надпочечников. В отличие от изображения на снимке расположенная слева масса выглядит неравномерной и имеет большие размеры — характерные особенности рака надпочечников.
ков при вскрытии выявляются у 10—20% людей. При обследовании таких лиц прежде всего нужно с помощью соответствующих скрининг-тестов выяснить, функционируют ли эти опухоли. Однако в 90% случаев опухоли, случайно выявляемые при КТ-сканировании области живота, оказываются нефункционирующими. К счастью, они редко бывают и злокачественными. Тем не менее нефункционирующие опухоли ставят перед врачом ряд трудных вопросов. Так как 20%) раков надпочечников — нефункционирующие опухоли, следовало бы считать, что их всегда нужно удалять. Однако частота рака надпочечников по сравнению с частотой доброкачественных аденом коркового слоя низка (менее 1%), и в большинстве случаев хирургическая операция не показана. Иногда имеет значение размер опухоли: раковая опухоль надпочечников редко имеет диаметр менее 3 см, а надпочечниковые аденомы обычно не достигают 6 см (см. рис. 325-8). Если операцию не проводят, как правило, показано повторное КТ-сканирование через 3—6 мес.
Лечение. Опухоли надпочечников. Если установлен диагноз аденомы или рака надпочечников, опухоль удаляют. Из-за возможной атрофии второго надпочечника больного как до операции, так и после нее следует лечить, как при полной адреналэктомии, даже в том случае, если предполагают, что процесс односторонний; методика лечения сходна с таковой для больных с аддисоновой болезнью, подвергающихся оперативному вмешательству (см. табл.325-11).
Несмотря на хирургическую операцию, большинство больных с раком надпочечников погибают в течение 3 лет после установления диагноза. Метастазы чаще всего обнаруживаются в печени и легких. Основное противоопухолевое средство, используемое при лечении больных с метастазирующим раком надпочечников, — это хлодитан (о, p'-DDD) — изомер инсектицида ДДТ. Хлодитан подавляет продукцию кортизола и снижает уровень стероидов в плазме крови и моче. Хотя его цитотоксический эффект относительно избирателен для зоны коры надпочечников, секретирующей глюкокортикоиды, клубочковая зона тоже может быть ингибирована. Поскольку хлодитан меняет и вненадпочечниковый метаболизм кортизола, эффективность препарата следует оценивать по уровню кортизола в плазме и моче. Дозу хлодитана обычно дробят на 3—4 приема в день, постепенно увеличивая ее до 8—10 г в сутки. Почти у всех больных возникают побочные эффекты со стороны желудочно-кишечного тракта (анорексия, понос или рвота) или нервно-мышечной системы (ступор, сонливость или головокружение). Все больные, получающие хлодитан, должны находиться на длительной поддерживающей глюкокортикоидной терапии, причем следует вводить и определенные заместительные дозы минералокортикоидов. Примерно у 30% больных как опухоль, так и метастазы подвергаются регрессии, но, как уже отмечалось, долговременный прогноз неблагоприятный. У многих больных хлодитан только ингибирует стероидогенез, не вызывая регрессии метастазов опухоли. Костные метастазы обычно рефрактерны по отношению к препарату, и их следует подвергать облучению. Хлодитан можно применять и в качестве дополнительного средства после хирургической резекции рака надпочечников, даже при отсутствии видимых метастазов, поскольку прогноз этой опухоли столь неблагоприятен.
Двусторонняя гиперплазия.
У больных с гиперплазией имеет место относительное или абсолютное повышение уровня АКТГ. Поскольку терапия должна быть направлена на снижение этого уровня, идеальным способом основного лечения при АКТГ- или КРГ-продуцирующих опухолях, будь то гипофизарных или эктопических, является их хирургическое удаление. Иногда из-за чрезмерной запущенности болезни, особенно при эктопической продукции АКТГ, этого сделать невозможно. В таких случаях для коррекции избытка кортизола может быть показана «медикаментозная» или хирургическая адреналэктомия.
Мнения по поводу лечения при двусторонней гиперплазии надпочечников, когда источник гиперпродукции АКТГ остается неясным, противоречивы. В некоторых клиниках у таких больных (особенно при положительном результате «большого» теста с дексаметазоном) производят интраоперационное исследование гипофиза через транссфеноидальный доступ в надежде обнаружить микроаденому. Эти исследования оказываются успешными в 20—70% случаев в зависимости от опытности хирурга и способности рентгенолога до операции определить локализацию микроаденомы. Однако в том случае, если микроаденома не обнаружена, может потребоваться полная гипофизэктомия. Осложнения транссфеноидальной операции включают ринорею, несахарный диабет, пангипопитуитаризм и повреждение зрительных или других черепных нервов. Больше того, такие новообразования гипофиза могут рецидивировать, если первичное нарушение локализуется в гипоталамусе.
В других клиниках средством выбора считают полную адреналэктомию. Эффективность такого подхода близка к 100%, однако он сопряжен с необходимостью пожизненной минералокортикоидной и глюкокортикоидной заместительной терапии и вероятность развития у 10—20% больных опухоли гипофиза в ближайшие 10 лет, что часто требует хирургического лечения (синдром Нельсона). Неясно, развивается ли опухоль у таких больных de novo (см. гл. 321) или к моменту оперативного вмешательства она уже имелась, но была столь мала, что не выявлялась рентгенологически. У каждого больного, перенесшего двустороннюю адреналэктомию по поводу синдрома Кушинга, следовало бы периодически проверять состояние гипофиза с помощью КТ-сканирования и производить серийные определения уровня АКТГ. Опухоли гипофиза, которые выявляются после адреналэктомии, часто приобретают способность к местной инвазии и сдавливают перекрест зрительных нервов или распространяются в пещеристые или сфеноидальные синусы. Поэтому радикальный хирургический подход нередко требует послеоперационного облучения.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 902; Нарушение авторских прав?; Мы поможем в написании вашей работы!