
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механізм процесів дисоціації і утворення складних хімічних з’єднань
Механізм процесів утворення та дисоціації оксидів, карбонатів та других з’єднань однотипні. Розглянемо механізм дисоціації на прикладі розкладання карбонату кальцію, який розвивається таким чином. Карбонат і оксид мають іонні кристалічні решітки, у вузлах яких, наприклад у СаСО3, розміщені катіони Са2+ і аніони СО 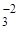 , а у СаО – Са2+ і О2–.
, а у СаО – Са2+ і О2–.
Сумарний процес дисоціації карбонату кальцію СаСО3(т) → СаО(т)+ СО2(г) складається з наступних стадій:
1. Розпад аніона СО 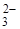 з утворенням адсорбованих на твердій поверхні молекул СО2,
з утворенням адсорбованих на твердій поверхні молекул СО2,
СО 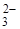 → О2–×СО2(адс).
→ О2–×СО2(адс).
2. Десорбція цих молекул, О2–×CO2(адс) → О2– + СО2(г).
У результаті 1 і 2 стадій в карбонаті залишаються пари іонів О2– і Са2+, які спочатку розташовуються в кристалічних решітках СаСО3, утворюючи розчин СаО в карбонаті.
3. Виникнення кристалів нової фази і їх зростання.
Оксид кальцію володіє малою розчинністю в карбонаті. У міру розвитку реакції і накопичення вказаних іонів розчин швидко стає насиченим, а надалі – пересиченим. Групи іонів Са2+ і О2– вже не можуть тривало утримуватися на старих позиціях, вони прагнуть відокремитися і створити енергетично вигіднішу конфігурацію, з меншим значенням ізобарного потенціалу, у вигляді кристалічних решіток вапна, відбувається розпад пересиченого розчину.
Стадії 1, 2 і 3 спільно є кристалохімічним перетворенням, в якому хімічна реакція супроводжується перебудовою кристалічних решіток.
4. Дифузія двоокису вуглецю.
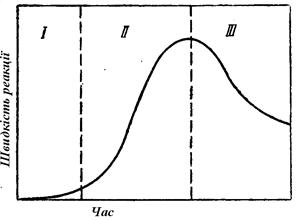
Для безперервного перебігу процесу необхідно весь час відводити газоподібний продукт дисоціації з реакційної зони, інакше відбудеться накопичення СО2 до рівноважної концентрації, і реакція припиниться. Дослідження в кінетичній області показали, що швидкість розкладання карбонатів при постійній температурі змінюється з часом по своєрідній залежності (рис. 2.7).
|
| Рис. 2.7 - Характер зміни швидкості дисоціації карбонатів при постійній температурі |
Спочатку, впродовж деякого відрізка часу, званого індукційним або інкубаційним періодом (I), не спостерігається видимого перетворення. З деякого моменту вже можна знайти ознаки реакції, і її швидкість спершу повільно, а потім все сильніше наростає. Це так званий період автокаталізу, самоускорення (II). Після досягнення максимуму швидкість починає убувати і реакція вступає в період усередненого фронту (III).
З'ясуємо, з чим пов'язана така закономірність.
А. Аніони СО 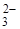 , розташовані на поверхні кристалів, деформовані і менш міцно пов'язані з решітками. Ще слабкіше зв'язані іони, що знаходяться на кутах кристалів або в місцях, де решітки спотворені і недобудовані. В таких дефектних місцях, званих активними центрами, створюються найсприятливіші умови для розкладання аніонів СO
, розташовані на поверхні кристалів, деформовані і менш міцно пов'язані з решітками. Ще слабкіше зв'язані іони, що знаходяться на кутах кристалів або в місцях, де решітки спотворені і недобудовані. В таких дефектних місцях, званих активними центрами, створюються найсприятливіші умови для розкладання аніонів СO 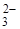 . Звичайно число вказаних центрів невелике, і це є однією з причин слабкого розвитку процесу в початковому, індукційному періоді.
. Звичайно число вказаних центрів невелике, і це є однією з причин слабкого розвитку процесу в початковому, індукційному періоді.
Інша причина пов'язана із значними труднощами виникнення зародків нової фази. Перебудова одних решіток в інших зв'язана із значним переміщенням іонів і вимагає відповідно великого пересищення системи.
Таким чином, впродовж індукційного періоду (I) в окремих активних центрах поступово зароджуються тривимірні кристали і створюється поверхня розділу між старою і новою фазами (рис. 2.8, а).
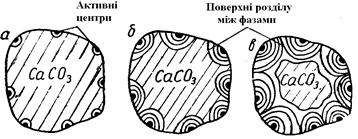
| Рис. 2.8 - Схема зростання нової фази на поверхні зразка, який дисоціює, залежно від часу витримки |
Б. Після цього розвиток процесу помітно полегшується. По-перше, випадає важка стадія зародження нової фази. Виниклі зародки кристалів вапна надалі тільки збільшуються в своїх розмірах. Добудова готових кристалів вимагає значно меншої енергії активації і протікає легше, ніж їх зародження. По-друге, процес розвивається вже не в окремих крапках, а на міжфазних поверхнях. Швидкість процесу зростає разом з сумарною величиною поверхні розділу. По ходу реакції вказана поверхня безперервно збільшується, відповідно до чого прогресивно наростає і швидкість перетворення (рис. 2.8, б).
В. По мірі розвитку перетворення розрізнені межі розділу навкруги окремих первинних центрів реакції зливаються в одну, а сумарний розмір міжфазної поверхні і відповідно швидкість досягають максимальних значень. Після цього величина поверхні, а з нею і швидкість убувають, починається третій етап – період (III) усередненого фронту (рис. 2.8, в).
Схема і закономірності розвитку зворотної реакції утворення карбонату приблизно такі ж, як і для прямої. Описаний механізм процесу називається автокатолітичним, він характерний для топохімічних перетворень, т. е. перетворень, що йдуть на поверхні розділу фаз, і багатьох інших реакцій.
|
|
Дата добавления: 2014-11-20; Просмотров: 438; Нарушение авторских прав?; Мы поможем в написании вашей работы!