
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механізми горіння гомогенних реакцій
|
|
|
|
Механізм процесів горіння добре описується теорією ланцюгових реакцій, розробленої М.М. Семеновим.
Теплове запалювання. При змішенні газоподібного пального, наприклад, СО, Н2, СН4, з окислювачем – киснем, при низьких температурах видимої взаємодії не спостерігається. Тільки при певній температурі, яку називають температурою запалювання (рис. 3. 2, точки М і Р), починається активна взаємодія між речовинами – горіння. Якщо відводити тепло, що виділяється, і підтримувати температуру системи постійної, то процес протікатиме стаціонарно. Проте за певних умов - тиску і температурі – процес починає розвиватися з такою колосальною швидкістю, що тепло вже не встигає відводитися – в замкнутому об'ємі відбувається майже миттєве виділення тепла і підвищення тиску – тепловий вибух. Процес переходить межу вибуху і протікає в нестаціонарному режимі. Розглянемо умови запалювання горючої суміші і переходу процесу у вибуховий режим.
|
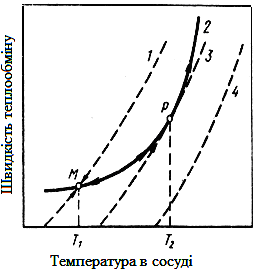
| Рис. 3.2 - Залежність швидкості теплообміну від температури судини при різному тиску газових сумішей: 1, 3, 4 – швидкість теплообміну; 2 – швидкість тепловиділення |
На рис. 3.2 представлена залежність швидкості виділення тепла при різному тиску q1 і відведення тепла q2 від температури в судині. Лінії 1,3,4 відповідають швидкості відведення тепла при різному тиску, р1 < р3 < р 4, а лінія 2 – швидкості виділення тепла. Перетин лінії 1, 3, 4 з віссю абсцис відповідає відсутності тепловідходу q2 = 0. При низьких температурах, нижчий Т1, виділяється тепло більше, ніж відводитися: q1>q2. Система розігрівається, швидшає виділення тепла по кривій 2, росте також швидкість тепловідходу по лінії 1. В точці М при Т1 q1 = q 2, встановлюється стаціонарний ізотермічний перебіг процесу. У випадку, якщо температура в судині перевищить Т1, то q1 < q 2, тобто тепла виділяється менше, ніж відводиться, і суміш знову охолодитися до Т1, стаціонарний перебіг процесу не буде порушено. Розглянемо відведення тепла при тиску р 3, лінія 3. При температурі Т2 лінії 2 і 3 перетинаються в точці Р, при цій температурі прихід тепла і відведення тепла рівні, але тут рівновага нестійка. Достатньо невеликого підвищення температури і прихід тепла перевищує його відведення, і система починає самонагріватися. Відбувається тепловий вибух. При вищому тиску р4 в судині (крива 4) стаціонарний, ізотермічний перебіг процесу неможливий, оскільки q1 > q2.
Ланцюговий механізм горіння. Ланцюговою називається реакція, що протікає через цикли, що повторюються, з участю вільних атомів і радикалів, так званих активних частинок. Процес перебігу реакції розділяються на зародження, розгалуження і обрив ланцюгів.
Перший етап процесу – зародження ланцюгів з утворенням активних частинок в результаті розпаду взаємодіючих молекул. Ця стадія вимагає введення в систему енергії. На другому етапі відбувається розвиток ланцюгів, який може йти з не розгалуженням і з розгалуженням. При перебігу реакції по не розгалуженому механізму число активних частинок не збільшується, замість однієї частинки, що прореагувала, виникає одна нова. У разі розгалуження ланцюга замість однієї активної частинки в ході реакції виникає дві-три інші. Третій етап процесу – обрив ланцюгів. Він пов'язаний із загибеллю активних частинок шляхом їх возз'єднання в нормальні частинки. Реакції, що відбуваються з розгалуженням ланцюгів, носять вибуховий характер.
Існують граничні верхні і нижні параметри, які визначають можливість протікання цих процесів. Вплив температури і тиску на запалювання представлений на рис 3.3.
|
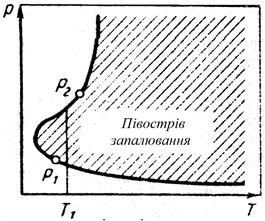
| Рис. 3.3 - Залежність верхньої і нижньої меж тиску запалювання від температури |
При тиску вище за верхню і нижче нижню межу вибуху - запалювання при даній температурі не відбудеться і розгалужена реакція розвиватися не буде. Наприклад, для температури Т 1 нижня межа рівна р 1, верхня межа - р 2. При тиску нижче р 1 кількість речовини в реакційній судині дуже мала для підтримки необхідного числа актів розгалуження ланцюгів. В інтервалі р 1 - р 2 частота зіткнення частинок зростає і число актів розгалуження ланцюгів перевищує число актів обриву ланцюгів, тобто загибелі активних частинок, наприклад на стінках судини. при тиску вища р 2 швидкість загибелі активних центрів ставати більше швидкості їх зародження. У межах р 1 - р 2 взаємодія між воднем і киснем протікає по ланцюговому механізму з розгалуженими ланцюгами.
При горінні водню в полум'ї знайдені наступні активні частинки: Н*, О*, ОН*. Ланцюги починаються з появою частинок гідрооксиду – ОН* Н2+О2 = 2ОН*. При зіткненні частинки ОН* з молекулою водню утворюється активна частинка Н*. Далі відбувається розгалуження ланцюга: Н* + О2 = ОН* + О*. З'являються дві нові частинки. Частинка ОН* взаємодіє з воднем, продовжуючи ланцюг, а інша – О*, стикаючись з молекулами Н2, утворює ще дві активні частинки: О* + Н2 = ОН* + Н*.

|
| Рис. 3.4 - Схема ланцюгової реакції горіння водню з розгалуженим ланцюгом |
Схема ланцюгової реакції горіння водню з розгалуженими ланцюгами приведена на рис. 3.4. Відбувається лавинний розвиток реакції із значним виділенням тепла в обмеженому об'ємі, що і є причиною вибуху.
Горіння СО, взаємодія метану з водяною парою – процес конверсії, також протікають по складній схемі ланцюгових реакцій.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 605; Нарушение авторских прав?; Мы поможем в написании вашей работы!