
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Відновлення оксидів газами
|
|
|
|
Термодинаміка відновлення оксидів металу СО: МеО + СО = Ме + СО2, 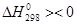 . Реакція може бути як екзотермічною, так і ендотермічною. Число ступенів свободи рівне С = 3 + 2 – 3 = 2. Прийнявши активності чистого металу і оксиду рівними одиниці, одержимо вираз константи рівноваги реакції Кp =
. Реакція може бути як екзотермічною, так і ендотермічною. Число ступенів свободи рівне С = 3 + 2 – 3 = 2. Прийнявши активності чистого металу і оксиду рівними одиниці, одержимо вираз константи рівноваги реакції Кp = 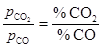 , оскільки %СО + %СО2 = 100, то
, оскільки %СО + %СО2 = 100, то  , отже,
, отже, 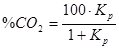 , тобто рівноважні концентрації СО і СО2 залежать тільки від температури. Якщо відновлення протікає з виділенням тепла, то Кр убуває, а %СОр збільшується з підвищенням температури (рис. 4.1). Для ендотермічного процесу виходить протилежна залежність.
, тобто рівноважні концентрації СО і СО2 залежать тільки від температури. Якщо відновлення протікає з виділенням тепла, то Кр убуває, а %СОр збільшується з підвищенням температури (рис. 4.1). Для ендотермічного процесу виходить протилежна залежність.

|
| Рис. 4.1 - Залежність рівноважного складу газу від температури в екзотермічній реакції відновлення СО |
Рівняння ізотерми Вант-Гоффа для даної реакції має вигляд 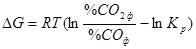 , з якого виходить, що при даній температурі напрям процесу і спорідненість МеО до СО залежать від співвідношення фактичних і рівноважних концентрацій СО і СО2. Якщо
, з якого виходить, що при даній температурі напрям процесу і спорідненість МеО до СО залежать від співвідношення фактичних і рівноважних концентрацій СО і СО2. Якщо  , то
, то  < 0, і суміш даного складу відновлюватиме оксид, в протилежному випадку – окислятиме метал. Проілюструємо сказане графіком (рис. 4.1). Крапки на кривій відповідають рівноважним умовам. Крапки вище за криву (наприклад, а) відповідає надлишку СО і недоліку СО2 порівняно з рівноважними концентраціями, тобто відновним газовим сумішам, оскільки
< 0, і суміш даного складу відновлюватиме оксид, в протилежному випадку – окислятиме метал. Проілюструємо сказане графіком (рис. 4.1). Крапки на кривій відповідають рівноважним умовам. Крапки вище за криву (наприклад, а) відповідає надлишку СО і недоліку СО2 порівняно з рівноважними концентраціями, тобто відновним газовим сумішам, оскільки  < 0. Нижче за криву розташовується крапки, що належать окислювальним по відношенню до даного металу сумішам,
< 0. Нижче за криву розташовується крапки, що належать окислювальним по відношенню до даного металу сумішам,  > 0.
> 0.
Рівновага реакції МеО + СО = Ме + СО2 визначається рівністю  =
= 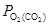 , де
, де 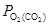 =
=  – рівноважний парціальний тиск О2 в реакції 2СО+О2 = 2СО2, який характеризує окислювальну здатність газової суміші.
– рівноважний парціальний тиск О2 в реакції 2СО+О2 = 2СО2, який характеризує окислювальну здатність газової суміші.
Підвищення міцності оксиду (зменшення його пружності дисоціації ( ) вимагає відповідного зниження
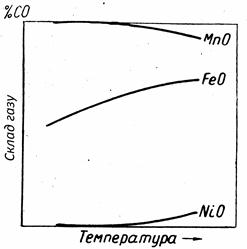
) вимагає відповідного зниження 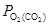 (окислювальної здатності), тобто зміни рівноважного складу газу у напрямі зменшення концентрації окислювача (СО2) і збільшення концентрації відновника (СО). Чим міцніше оксид, тим багатше відновником (СО) повинен бути газ і тим вище розташовуються рівноважні криві в координатах %СО = j(Т) (рис. 4.2).
(окислювальної здатності), тобто зміни рівноважного складу газу у напрямі зменшення концентрації окислювача (СО2) і збільшення концентрації відновника (СО). Чим міцніше оксид, тим багатше відновником (СО) повинен бути газ і тим вище розташовуються рівноважні криві в координатах %СО = j(Т) (рис. 4.2).
|
| Рис. 4.2 - Схема залежності рівноважного складу газу від температури в реакціях відновлення різних оксидів газом СО |
А. А. Байков запропонував наступну класифікацію оксидів:
І – легковідновні оксиди Cu2O, NiO, CoO, Fe2O3, Mn2O3, MnO2 легко віддають О2, в газовій фазі %СО ® 0, а %СО2 ® 100%, відновлення протікає практично необоротно. Реакції відновлення протікають з виділенням тепла + Q, К>> 1.
ІІ – оксиди важковідновні, великої хімічної міцності MnO, SiO2, Al2O3, CaO. Рівноважна газова фаза містить близько 100% СО, протікають з поглинанням тепла (– Q), К < < 1.
ІІІ – оксиди проміжної хімічної міцності Fe3O4, FeO, Mn3O4, WO2 і т.п. Рівноважний склад газу містить сумірні кількості СО і СО2. Реакції або слабкоендотермічні або слабкоекзотермічні.
Термодинаміка відновлення воднем: МеО + Н2 = Ме + Н2О, 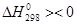 .
.
Реакція може бути як екзотермічною, так і ендотермічною. Число ступенів свободи рівне С = 3 + 2 – 3 = 2. Прийнявши активності чистого металу і оксиду рівними одиниці, одержимо вираз константи рівноваги реакції Кp =  , оскільки %Н2 + %Н2О = 100, то
, оскільки %Н2 + %Н2О = 100, то  , отже,
, отже,  , тобто рівноважні концентрації Н2 і Н2О залежать тільки від температури. За хімічною міцністю оксиди також діляться, як і при відновленні СО, на три групи.
, тобто рівноважні концентрації Н2 і Н2О залежать тільки від температури. За хімічною міцністю оксиди також діляться, як і при відновленні СО, на три групи.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 488; Нарушение авторских прав?; Мы поможем в написании вашей работы!