
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теорія відновних процесів
|
|
|
|
У чорній металургії більшість металів в природному стані знаходиться у вигляді оксидів – це оксиди заліза, марганцю, хрому, кремнію та інші. Для витягання металу з руди у виробництві здійснюють процес відновлення. Процес відновлення можна розглядати і як окислювальний відносно відновника, оскільки віднімаючи кисень з молекули оксиду металу, він сам відновник – окислюється. Тому загалом ці процеси відносять до окислювально-відновних.
Реакція окислювально-відновного типу записуються у вигляді МеО + В = Ме + В; D Н ³£ 0.
Підсумовуванням двох реакцій, утворення оксиду відновника і утворення оксиду металу, одержуємо реакцію відновлення
1. В + 1/2О2 = ВО
-
2. Ме + 1/2О2 = МеО
3. МеО + В = ВО + Ме
По другому закону термодинаміки D G3 = D G1 – D G2, D G = – RT ln KP = RT ln 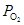 ,
,
К3 = К1/К2 = 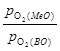 .
.
Для здійснення відновлення D G3 повинно бути менше 0, це можливо коли D G1 < D G2, тобто спорідненість відновника до кисню більш ніж спорідненість металу до кисню. Відновником по відношенню до оксиду металу може бути будь-який елемент із спорідненістю до кисню більшим, ніж у відновлюваного металу, тобто D G ВО < D G МеО або 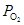 (BO) <
(BO) < 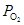 (MeO).
(MeO).
Таким чином, окислювально-відновні реакції знаходяться в рівновазі, якщо за даних умов (температурі, складі розчинів, ступені дисперсності фаз і т.п.) речовини Ме і В володіють однаковою спорідненістю до О2, тобто пружності дисоціації їх оксидів рівні між собою. За відсутності рівноваги ці реакції завжди протікають у напрямі утворення міцнішого оксиду або оксиду з меншою в даних умовах пружністю дисоціації. Як відновники використовують лише ті речовини, які в даних умовах володіють великою спорідненістю до О2, ніж відновлювані.
Керуючись цим і використовуючи розташування елементів за збільшенням спорідненість до кисню можна підібрати відновник для речовини, що цікавить нас. Залізо легко відновлюється Mn, Si, Al і т.д., навпаки, мідь і нікель не придатні для цієї мети. Вживання вказаних відновників виправдано при розкислюванні стали і в, так званих, металотермічних процесах. Відновниками звичайно служать кремній (силікотермія) і алюміній (алюмінотермія). Ці процеси використовується для отримання безвуглецевих феросплавів. Реакції відновлення при металотермічном відновленні протікають з виділенням тепла. Згідно правила Жемчужного процес може йти без зовнішнього підігріву, якщо на 1 г шихти виділяється не менше 2300 Дж теплоти.
Для масового виробництва різних сортів чавуну і звичних феросплавів використовують порівняно дешевий і широко поширений в природі відновник – вуглець. Процес називається вуглетермічним, який супроводжується неминучим навуглецьовуванням відновлених елементів
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 390; Нарушение авторских прав?; Мы поможем в написании вашей работы!