
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Відновлення з участю розчинів
|
|
|
|
Окислювально-відновні реакції в реальних процесах протікають, як правило, з участю компонентів, що знаходяться в твердих і рідких розчинах.
Відновлення з розчину (FeO) + CO = Feк + СО2.
Вираз константи рівноваги має вигляд  , звідки
, звідки 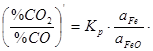 . Прийнявши, що активність розчинника а Fe» 1 і враховуючи, що
. Прийнявши, що активність розчинника а Fe» 1 і враховуючи, що  ; Кр =
; Кр =  (для чистих компонентів), де
(для чистих компонентів), де  і
і  – коефіцієнт активності і концентрація (молярна частка) FeO в розчині, одержимо
– коефіцієнт активності і концентрація (молярна частка) FeO в розчині, одержимо  . Звідки витікає, що в ненасичених розчинах (коли
. Звідки витікає, що в ненасичених розчинах (коли  < 1)
< 1)  , тобто рівноважний газ бідніший СО2 і багатше СО, ніж у разі реакції з чистими фазами. Із зменшенням концентрації FeO зменшується
, тобто рівноважний газ бідніший СО2 і багатше СО, ніж у разі реакції з чистими фазами. Із зменшенням концентрації FeO зменшується  , тобто %СО2 прагне до нуля, % СО – 100%. Таким чином, чим нижчий вміст оксиду в розчині, тим його важче відновлювати і тимбагатше відновником повинна бути газова суміш.
, тобто %СО2 прагне до нуля, % СО – 100%. Таким чином, чим нижчий вміст оксиду в розчині, тим його важче відновлювати і тимбагатше відновником повинна бути газова суміш.
При прямому відновленні процес складається з наступних реакцій
(FeO) + CO = Feк + СО2
+

 СО2 + Ст = 2СО
СО2 + Ст = 2СО
(FeO) + Ст = Feк + СО
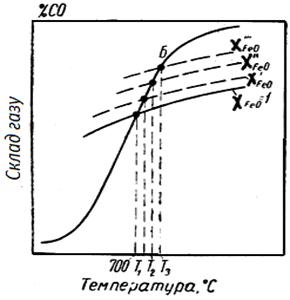
З рис. 4.5 видно, що кожному вмісту FeO в розчині відповідає своя точка перетину з рівноважної кривої реакції взаємодії СО2 з вуглецем (крива б), або своя температура початку реакції прямого відновлення Т р, і чим нижче X FeO, тим вище Т р.
У міру зменшення концентрації оксиду його стає все важче відновлювати твердим вуглецем, що виявляється в підвищенні температури початку реакції.
Перехід продукту відновлення в розчин MnOк + СОг = [Mn] + CO2;  .
.
Для MnO, як чистої фази  = 1;
= 1;  , отже,
, отже, 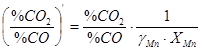 . У присутності розчинника, коли
. У присутності розчинника, коли  < 1, рівноважний склад газу бідніший СО, ніж при отриманні чистого металу. Інакше, під час переходу продукту реакції в розчин умови відновлення оксиду полегшується. На рис. 4.6 кожному вмісту марганцю в залізі відповідає своя рівноважна крива складу газової фази реакції непрямого відновлення: чим менше
< 1, рівноважний склад газу бідніший СО, ніж при отриманні чистого металу. Інакше, під час переходу продукту реакції в розчин умови відновлення оксиду полегшується. На рис. 4.6 кожному вмісту марганцю в залізі відповідає своя рівноважна крива складу газової фази реакції непрямого відновлення: чим менше  , тим нижче розташовується крива. При прямому відновленні полегшення умов для протікання реакції MnOк + Ст = [Mn]Fe + CO виявляється в зниженні температури, вище за яку стає можливою взаємодія: Т 3 < Т 2 < Т 1 < 1420°С.
, тим нижче розташовується крива. При прямому відновленні полегшення умов для протікання реакції MnOк + Ст = [Mn]Fe + CO виявляється в зниженні температури, вище за яку стає можливою взаємодія: Т 3 < Т 2 < Т 1 < 1420°С.
| 
|
Рис. 4.5 - Рівноважний склад газу і температури початку відновлення в реакціях непрямого і прямого відновлення FeO 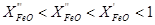
| Рис. 4.6 - Рівноважний склад газу і температури рівноваги в реакціях непрямого і прямого відновлення оксиду марганцю 
|
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 418; Нарушение авторских прав?; Мы поможем в написании вашей работы!