
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое равновесие
|
|
|
|
Рассматривая любой химический процесс, например:
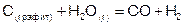 ,
,
необходимо учитывать его обратимость, т.е. протекание в двух направлениях: прямом, когда реагенты (С и Н2О) образуют продукты (СО и Н2) и в обратном, когда взаимодействие продуктов дает исходные вещества. Хотя известны процессы, протекающие только в одном направлении (необратимо), все же большинство их обратимы (т.е. ни одно из реагирующих соединений не расходуется полностью [8]).
Со временем обратимая реакция достигает состояния химического равновесия, характеризующегося неизменностью во времени концентраций всех веществ. (Однако следует помнить, что химическое равновесие является динамическим, т.е. при этом протекают и прямой, и обратный процессы, но, сколько соединения расходуется по первому, столько же его возникает по второму.)
Состояние химического равновесия характеризуется термодинамической константой. Для реакции (1), ее выражение:
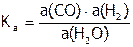 ,
,
где 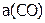 ,
, 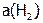 и
и 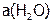 – равновесные активности. Напомним, что активности веществ – это их эффективные концентрации, которые рассчитываются по формуле:
– равновесные активности. Напомним, что активности веществ – это их эффективные концентрации, которые рассчитываются по формуле:  , где С – молярная концентрация соединения, а
, где С – молярная концентрация соединения, а 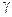 – коэффициент его активности. Кроме того, для чистых жидкостей и твердых веществ (в нашем примере – графит) при данной Т активности являются постоянными величинами и потому входят в значение
– коэффициент его активности. Кроме того, для чистых жидкостей и твердых веществ (в нашем примере – графит) при данной Т активности являются постоянными величинами и потому входят в значение 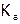 а в выражение константы вместо них ставят единицу [8].
а в выражение константы вместо них ставят единицу [8].
На практике удобнее пользоваться концентрационной константой равновесия (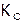 ). Для рассмотренной реакции
). Для рассмотренной реакции 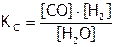 , где квадратными скобками обозначают равновесные молярные концентрации соединений. Отметим, что если
, где квадратными скобками обозначают равновесные молярные концентрации соединений. Отметим, что если 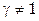 , то
, то 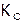 лишь приблизительно равно
лишь приблизительно равно 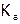 .
.
При изменении (под внешним воздействием) параметров системы: Т, р или С веществ, – равновесие нарушается и устанавливается новое (при других значениях концентрации соединений), т.е. имеет место сдвиг химического равновесия.
Направление, в котором происходит этот сдвиг, определяется принципом Ле Шателье: изменение температуры, давления или концентрации в системе, произошедшее под внешним воздействием, вызывает смещение равновесия в направлении реакции (прямой или обратной), ослабляющей произведенное изменение.
ЛАБОРАТОРНАЯ РАБОТА «Равновесие»
Примечание. При оформлении отчета для всех процессов, которые будут осуществлены в данной работе, привести выражения констант равновесия (не забывая, что они записываются только по сокращенному ионному виду уравнения).
1. Влияние концентрации реагирующих веществ на состояние химического равновесия. Поместить 1 г хлорида калия в фарфоровую чашку (опыт проводить под тягой!) и прилить 10 мл конц.HNO3. Поставить чашку на водяную баню и выпарить досуха. Примерно 1/10 сухого остатка растворить в воде и добавить раствор нитрата серебра (реактив на Cl–). Что наблюдается и почему?
Повторить выпаривание 2–3 раза, каждый раз добавляя к сухому остатку по 10мл концентрированной азотной кислоты и анализируя остаток (после выпаривания) на присутствие хлорид-ионов. Каковы результаты?
Затем к полученной соли прилить 10 мл конц.HCl и выпарить на водяной бане. Часть остатка растворить в 0,5 мл воды и добавить 1 каплю нитрата серебра.
Объяснить все результаты, исходя из того, что процессы, происходящие при выпаривании растворов можно отразить схемой:
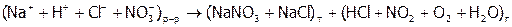 .
.
Очевидно, чем больше в растворе будет 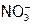 -ионов, тем выше доля N-содержащих продуктов, в том числе и
-ионов, тем выше доля N-содержащих продуктов, в том числе и 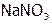 в твердом остатке после выпаривания. (И аналогично при увеличении концентрации хлорид-ионов в растворе – больше доля NaCl.)
в твердом остатке после выпаривания. (И аналогично при увеличении концентрации хлорид-ионов в растворе – больше доля NaCl.)
2. Влияние температуры на состояние химического равновесия
а) В водном растворе. В растворе аммиака существуют равновесия:
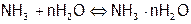 ,
, 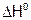 <0;
<0;
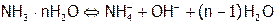 ,
, 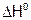 >0.
>0.
Куда при повышении Т смещается равновесие второго процесса? Почему?
Проверить вывод на опыте, для чего в пробирку налить 3-4 мл воды, добавить 6 капель 0,3%-го раствора аммиака и каплю фенолфталеина. Нагреть смесь на водяной бане, затем охладить. Что наблюдается? Объяснить результаты эксперимента.
б) В газовой фазе. Для реакции димеризации диоксида азота:
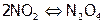 ,
, 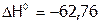 кДж/моль;
кДж/моль;
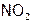 – бурый газ, а
– бурый газ, а 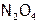 – почти бесцветный. Таким образом, по изменению окраски газовой смеси можно судить об изменении концентрации ее компонентов, то есть о смещении равновесия в сторону прямой или обратной реакции.
– почти бесцветный. Таким образом, по изменению окраски газовой смеси можно судить об изменении концентрации ее компонентов, то есть о смещении равновесия в сторону прямой или обратной реакции.
При выполнении опыта (проводить под тягой!) вначале получить оксид азота(IV). Для этого в колбу Вюрца насыпать немного медной стружки, добавить конц.HNO3, закрыть пробкой с газоотводной трубкой и очень осторожно нагреть.
Образующимся газом заполнить V-образную трубку, после чего оба ее конца плотно закрыть резиновыми пробками и, перевернув концами вниз, поместить одно колено в стакан с горячей водой, другое – с холодной водой. Наблюдается ли изменение окраски? Затем поменять положение концов трубки и через 2–3 минуты снова отметить – есть ли изменение окраски.
В каком направлении происходит смещение равновесия при нагревании? при охлаждении? Почему? Объясните с помощью принципа Ле-Шателье.
3. Влияние рН раствора на состояние химического равновесия
а) Гомогенное равновесие. Ионы 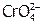 придают раствору желтый цвет, а
придают раствору желтый цвет, а 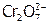 – оранжевый, причем в растворах солей и хроматов, и дихроматов устанавливается равновесие:
– оранжевый, причем в растворах солей и хроматов, и дихроматов устанавливается равновесие:
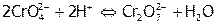 ,
, 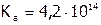 .
.
К 3 каплям дихромата калия (отметить его цвет) прибавить 2 капли 1М NaOH. Изменяется ли окраска раствора. Затем прибавлять к нему по каплям 1М серную кислоту до тех пор, пока цвет не станет прежним. Каковы причины его изменений? Объяснить, используя приведенное уравнение равновесия.
б) Гетерогенная система. В пробирку налить 2 мл раствора хлорида магния и медленно (по каплям при перемешивании) добавлять 1М щелочи до образования обильного осадка (не более!). Взболтать его, и полученную суспензию разлить в три пробирки. Первую оставить для сравнения, во вторую прилить 1 мл 1М HCl, а в третью – 2 мл 1М хлорида аммония. Что при этом наблюдается? Объясните результаты эксперимента, используя уравнение равновесия:
Mg(OH)2 = Mg2+ + 2OH–.
Какие выводы можно сделать на основании опытов 2 и 3?
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 1192; Нарушение авторских прав?; Мы поможем в написании вашей работы!