
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопросы к коллоквиуму I
|
|
|
|
1. Первый закон термодинамики. Внутренняя энергия, энтальпия.
2. Закон Гесса, следствия из него и их приложения. Экзо- и эндоэффекты. Причины выделения и поглощения энергии при химических процессах.
3. Энтропия, ее размерность и физический смысл. Стандартные энтропии веществ, расчет изменения энтропии в ходе реакции.
4. Свободная энергия (G), 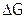 и
и 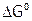 , формула Гиббса. Оценка возможности протекания химического процесса (по стандартным значениям энтальпий образования и энтропий веществ) при разной температуре.
, формула Гиббса. Оценка возможности протекания химического процесса (по стандартным значениям энтальпий образования и энтропий веществ) при разной температуре.
5. Химическое равновесие, его признаки, истинное и ложное равновесие. Константа химического равновесия, её физический смысл.
6. Размерность константы равновесия. Связь со стандартным изменением энергии Гиббса. Концентрационная константа равновесия.
7. Сдвиг химического равновесия. Принцип Ле-Шателье. Влияние различных факторов на положение равновесия и на величину константы равновесия. Примеры.
8. Скорость химической реакции (гомогенной, гетерогенной). Влияние различных условий на кинетику процесса.
9. Кинетическое уравнение. Порядок реакции по веществу и общий порядок, их связь со стехиометрическими коэффициентами. Как определяются порядки многостадийных процессов. Формально-кинетическое уравнение. Молекулярность реакции.
10. Меняется ли скорость процесса в ходе его протекания? Равновесие с точки зрения кинетики.
11. Константы скорости прямой и обратной реакции, их размерность и связь с константой равновесия. Что такое необратимые процессы с позиции термодинамики? кинетики? Условия их протекания.
12. Факторы, влияющие на константу скорости реакции. Зависимость ее от температуры. Формула Вант-Гоффа и уравнение Аррениуса. Энергия активации.
13. Типы химических реакций (параллельные, последовательные, сопряженные). Цепные процессы.
14. Катализ и автокатализ. Ингибиторы и промоторы. Механизм действия катализатора. Влияет ли наличие его на равновесие реакции? на величину ее константы? А температура? Роль катализаторов в природе и в промышленности.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 570; Нарушение авторских прав?; Мы поможем в написании вашей работы!