
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворимость электролитов
|
|
|
|
Произведение растворимости. Электролиты – это соединения, растворы которых проводят ток. Абсолютно нерастворимых веществ нет, поэтому в растворе над осадком даже малорастворимого электролита, всегда находится некоторое количество его ионов. Причем концентрация насыщенного раствора (т.е. находящегося в равновесии с осадком) считается растворимостью (s) данного электролита[22]. А произведение активностей ионов осадка в его насыщенном растворе называется произведением растворимости [8]. Например, между малорастворимым соединением 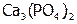 и его водным раствором устанавливается равновесие:
и его водным раствором устанавливается равновесие:
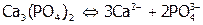 и
и 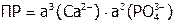 ,
,
или менее строго (т.е. если вместо активностей брать концентрации):
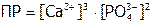 .
.
Проводя анализ раствора, равновесного с данным осадком при стандартных условиях (ст.у.), определяют его s (например, в моль/л). В соответствии с уравнением растворения: 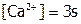 ,
, 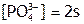 , а, следовательно:
, а, следовательно: 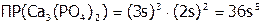
Примеры решения задач.
Задача №1. Растворимость AgCl при 250С составляет 0,0018 г/л. Вычислить произведение растворимости хлорида серебра.
Решение: 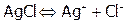 ;
; 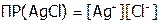 . Выразим растворимость через моль/л. Поскольку
. Выразим растворимость через моль/л. Поскольку 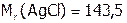 г/моль, то имеем:
г/моль, то имеем:
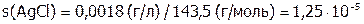 моль/л.
моль/л.
При переходе в раствор 1 моль AgCl образует по 1 моль 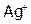 и
и 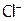 , следовательно, если растворилось
, следовательно, если растворилось 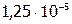 моль/л, то над осадком:
моль/л, то над осадком:
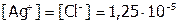 моль/л,
моль/л,
поэтому: 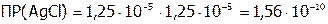 .
.
Задача №2. Рассчитать массу AgCl в 100 мл его насыщенного раствора, если 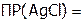 1,56.10–10.
1,56.10–10.
Решение: 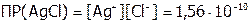 . И поскольку в данном случае s (см. задачу №1) равна концентрации каждого из ионов осадка AgCl, а они равны между собой, следовательно:
. И поскольку в данном случае s (см. задачу №1) равна концентрации каждого из ионов осадка AgCl, а они равны между собой, следовательно:
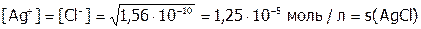 .
.
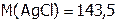 г/моль, т.е. 143,5 г составляет 1 моль,
г/моль, т.е. 143,5 г составляет 1 моль,
а X г – 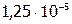 моль.
моль.
Решая данную пропорцию, получим: 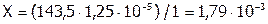 (г) – это масса AgCl, содержащегося в 1 л раствора или в 1000 мл; а при расчете на 100 мл:
(г) – это масса AgCl, содержащегося в 1 л раствора или в 1000 мл; а при расчете на 100 мл: 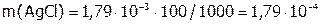 (г).
(г).
Задача №3. Вычислить, в каком объеме раствора содержится 1 г сульфата стронция, если его 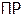 равно
равно 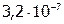 .
.
Решение: 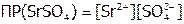 . Пусть
. Пусть 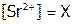 , тогда и
, тогда и 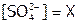 ,
,
а 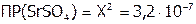 ; откуда
; откуда 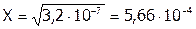 моль/л.
моль/л.
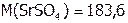 г/моль; значит,
г/моль; значит, 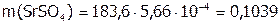 г SrSO4.
г SrSO4.
Итак, 0,1039 г SrSO4 находится в 1 л раствора,
а 1 (г) будет содержаться в Y л раствора.
Решая пропорцию, получим: 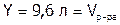 .
.
Влияние различных факторов на s и ПР. Произведение растворимости (ПР) является термодинамической константой равновесия для процесса растворения, т.е. его значение не зависит от состава раствора (в отличие от s), а лишь от температуры, модификации данного осадка и природы растворителя. (Чем полярнее молекулы последнего, тем больше скорость прямого процесса (растворения), но меньше обратного (осаждения), и, следовательно, выше концентрация насыщенного раствора, т.е. больше величины s и ПР.)
Влияние температуры на s и ПР. Согласно принципу Ле-Шателье, если растворение соли является экзопроцессом, то ее растворимость, а, значит, и ПР с ростом Т уменьшаются [8]. Для большинства солей растворение – это эндопроцесс, и величина их s и ПР при повышении температуры растут, причем тем резче, чем больше эндоэффект. 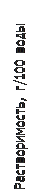
 Например, нитрат калия KNO3 растворяется со значительным поглощением тепла (
Например, нитрат калия KNO3 растворяется со значительным поглощением тепла (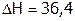 кДж/моль), поэтому с ростом Т его растворимость резко увеличивается (рис. 7). Теплота растворения хлорида натрия тоже положительна, но мала по величине (
кДж/моль), поэтому с ростом Т его растворимость резко увеличивается (рис. 7). Теплота растворения хлорида натрия тоже положительна, но мала по величине (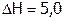 кДж/моль), как следствие, s(NaCl) мало меняется с изменением Т Более сложный вид имеет температурная зависимость s сульфата натрия. До 320С кривая поднимается; далее при 320С происходит ее излом, после чего она несколько снижается. Это объясняется тем, что ниже 320С в равновесии с насыщенным раствором находится вещество
кДж/моль), как следствие, s(NaCl) мало меняется с изменением Т Более сложный вид имеет температурная зависимость s сульфата натрия. До 320С кривая поднимается; далее при 320С происходит ее излом, после чего она несколько снижается. Это объясняется тем, что ниже 320С в равновесии с насыщенным раствором находится вещество 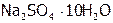 , растворение которого идет с эндоэффектом. Но при 320C это соединение, обезвоживаясь, переходит в продукт, который растворяется с выделением тепла.
, растворение которого идет с эндоэффектом. Но при 320C это соединение, обезвоживаясь, переходит в продукт, который растворяется с выделением тепла.
Ненасыщенные и пересыщенные растворы. Раствор может быть ненасыщенным, когда произведение активностей ионов электролита( ) в растворе меньше величины его ПР (
) в растворе меньше величины его ПР ( <ПР) и тогда, естественно, осадок не образуется.
<ПР) и тогда, естественно, осадок не образуется.
Раствор может быть также пересыщенным (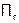 >ПР). Это состояние является неравновесным и должно приводить к выпадению осадка (приход к равновесию!). Если же этого не происходит, то лишь из-за кинетического фактора, а именно: тормозится стадия образования зародышей (это агрегаты частиц электролита достаточно устойчивые, чтобы они могли быть центрами формирования осадка). Поэтому, когда стадия образования зародышей перестает быть лимитирующей (например, при внесении кристаллика в раствор), то выпадает осадок, и система становится равновесной, т.е. пересыщенный раствор переходит в насыщенный.
>ПР). Это состояние является неравновесным и должно приводить к выпадению осадка (приход к равновесию!). Если же этого не происходит, то лишь из-за кинетического фактора, а именно: тормозится стадия образования зародышей (это агрегаты частиц электролита достаточно устойчивые, чтобы они могли быть центрами формирования осадка). Поэтому, когда стадия образования зародышей перестает быть лимитирующей (например, при внесении кристаллика в раствор), то выпадает осадок, и система становится равновесной, т.е. пересыщенный раствор переходит в насыщенный.
Влияние одноименного иона на растворимость. Если в равновесную систему «осадок-раствор» вводят растворимый электролит содержащий ионы, входящие в состав осадка, то это называют введением одноименных ионов. При их введении раствор становится пересыщенным (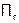 >ПР), поэтому из него дополнительно выпадает осадок, что снижает концентрации ионов этого осадка в растворе. А поскольку значение ПР не зависит от состава раствора, то увеличение концентрации одного из одноименных ионов (действием извне!) приводит к уменьшению концентрации другого в такой степени, чтобы произведение их активностей (
>ПР), поэтому из него дополнительно выпадает осадок, что снижает концентрации ионов этого осадка в растворе. А поскольку значение ПР не зависит от состава раствора, то увеличение концентрации одного из одноименных ионов (действием извне!) приводит к уменьшению концентрации другого в такой степени, чтобы произведение их активностей (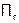 ) снова стало равным ПР. Итак, введение в раствор одноименных ионов уменьшает растворимость осадка. (Максимальная s наблюдается в отсутствии в растворе избытка каждого из ионов, входящих в его состав.)
) снова стало равным ПР. Итак, введение в раствор одноименных ионов уменьшает растворимость осадка. (Максимальная s наблюдается в отсутствии в растворе избытка каждого из ионов, входящих в его состав.)
Отметим, что, добавляя к ненасыщенному раствору (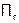 <ПР) одноименные ионы, можно превратить его в насыщенный (
<ПР) одноименные ионы, можно превратить его в насыщенный (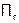 =ПР), затем в пересыщенный (
=ПР), затем в пересыщенный (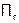 >ПР) и таким образом вызвать образование осадка.
>ПР) и таким образом вызвать образование осадка.
Влияние посторонних ионов на растворимость. Солевой эффект. В растворе над осадком концентрация электролита мала (менее 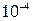 М), т.е. катионы и анионы удалены друг от друга, и значит, слабо взаимодействуют, следовательно, их активности практически будут равны концентрациям.
М), т.е. катионы и анионы удалены друг от друга, и значит, слабо взаимодействуют, следовательно, их активности практически будут равны концентрациям.
Однако при добавлении к подобной системе достаточного количества хорошо растворимого электролита, не содержащего одноименных ионов, (т.е. соли с «посторонними» ионами) электростатическое взаимодействие частиц в растворе становится значительным и приводит к тому, что каждый ион окружает себя ионами противоположного знака. Из-за этого активность ионов осадка снижается, т.е. раствор становится ненасыщенным (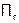 <ПР), поэтому часть осадка растворяется (s увеличивается). Такое явление называется солевым эффектом.
<ПР), поэтому часть осадка растворяется (s увеличивается). Такое явление называется солевым эффектом.
Однако если концентрация «посторонней» соли будет слишком высокой, то наблюдается обратный процесс – высаливание, т.е. снижение величины s в результате связывания молекул воды ионами добавленной соли в гидраты.
Переосаждение. Растворение осадка. Если к раствору, находящемуся в равновесии с осадком, например, 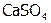 добавить электролит
добавить электролит 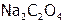 , содержащий анионы, которые с катионами данного осадка образуют менее растворимое соединение
, содержащий анионы, которые с катионами данного осадка образуют менее растворимое соединение 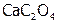 (табл. 12), то относительно последнего раствор становится пересыщенным, поэтому образуется этот новый осадок. В результате чего из-за снижения концентрации
(табл. 12), то относительно последнего раствор становится пересыщенным, поэтому образуется этот новый осадок. В результате чего из-за снижения концентрации 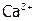 получим:
получим: 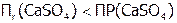 . Поэтому растворится часть исходного осадка, что опять повысит концентрацию
. Поэтому растворится часть исходного осадка, что опять повысит концентрацию 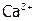 , т.е. снова:
, т.е. снова: 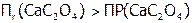 , и новая порция
, и новая порция 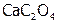 выпадет в осадок. И так продолжится до практически полного перехода
выпадет в осадок. И так продолжится до практически полного перехода 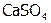 в
в 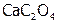 . Такое явление называется переосаждение. (Самостоятельно с учетом данных, приведенных в таблице 2, рассмотрите случай, когда к осадку
. Такое явление называется переосаждение. (Самостоятельно с учетом данных, приведенных в таблице 2, рассмотрите случай, когда к осадку 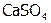 добавляется раствор
добавляется раствор 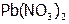 .)
.)
Рассуждая аналогично, получим, что если ионы осадка связываются в достаточно прочное[23] малодиссоциирующее вещество, то можно вызвать полное растворение осадка. Например, 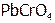 растворяется в щелочи из-за снижения активности
растворяется в щелочи из-за снижения активности 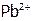 над осадком в результате образования слабодиссоциирующего комплекса
над осадком в результате образования слабодиссоциирующего комплекса 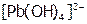 , а также в кислотах (например, в
, а также в кислотах (например, в 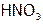 ) вследствие перехода ионов
) вследствие перехода ионов 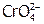 в устойчивые димеры[24]
в устойчивые димеры[24] 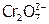 , не осаждающие Pb(II).
, не осаждающие Pb(II).
ЛАБОРАТОРНАЯ РАБОТА «Растворимость и ПР»
ПРИМЕЧАНИЕ. При оформлении отчета привести уравнения равновесий всех проведенных в работе процессов в сокращенном ионном виде.
1. Влияние температуры на растворимость соли.
а) Ацетат кальция. В сухую пробирку налить насыщенный раствор ацетата кальция (прозрачный) и нагреть его почти до кипения. Что наблюдается? Сделать вывод. Охладить содержимое пробирки струей водопроводной воды. Что при этом происходит? Каков знак теплового эффекта растворения данной соли?
б) Алюмокалиевые квасцы. Отвесить в пробирке 2 г алюмокалиевых квасцов, добавить 3 мл воды и тщательно перемешать (в течение 5 мин.). Происходит ли при этом полное растворение квасцов? Нагреть содержимое пробирки почти до кипения. Что наблюдается? Каков знак теплового эффекта растворения данного вещества?
Часть раствора отлить в пробирку и быстро охладить под краном. Остальной раствор оставить охлаждаться медленно. Рассмотреть под микроскопом и зарисовать форму кристаллов, полученных при быстрой и медленной кристаллизации. Как следует охлаждать насыщенный раствор для получения крупных кристаллов?
2. Определение растворимости хлорида натрия (1 опыт на группу). В стакане на 100 мл смешать 20 г хлорида натрия и 30 мл воды. Нагреть смесь почти до кипения (при перемешивании). Осторожно слить прозрачный раствор в сухой стакан на 100 мл и наблюдать явления, происходящие при его охлаждении.
Взвесить фарфоровую чашку (с точностью до 0,01 г.) Измерив температуру остывающего раствора, часть его сразу же слить его в фарфоровую чашку (так, чтобы кристаллы не попали в нее!). После остывания взвесить чашку с раствором и выпарить досуха раствор в сушильном шкафу. (Рассмотреть кристаллы хлорида натрия, выпавшие в стакане, под микроскопом и зарисовать их форму.) После выпаривания охладить фарфоровую чашку с кристаллами в эксикаторе и взвесить ее. Рассчитать растворимость хлорида натрия при измеренной температуре, сравнить со справочными данными, оценить и объяснить возможную ошибку опыта.
3. Осаждение катионов бария. Переосаждение. Растворение. К 1 мл хлорида бария добавить 2 мл раствора оксалата аммония. Отметить цвет осадка. Разделить его на 2 пробирки и отфуговать. Центрифугат слить в 2 другие пробирки и в одну добавить 1 мл оксалата аммония (для чего?), а в другую – 1 мл раствора дихромата калия. Дать объяснение происходящему. Какой из анионов более полно осаждает ионы бария и почему? (Сравните с данными табл. 12).
Таблица 12. Значения ПР некоторых малорастворимых электролитов при 250С
| Вещество | ПР | Вещество | ПР |
| AgCl AgBr AgI BaC2O4 BaSO4 BaCrO4 | 1,6 . 10 -10 7,7 . 10 -13 1,5 . 10 -16 1,2 . 10 -7 1,1 . 10 -10 2,4 . 10 -10 | CaSO4 CaC2O4 Mg(OH)2 PbSO4 PbCrO4 HgS | 6,1. 10 -5 2,6. 10 -8 5,0. 10 -12 2,0. 10 -8 1,8. 10 -14 4,0. 10 -53(при 180С) |
В обе пробирки с осадками оксалата бария пролить по 1 мл дихромата калия. Что наблюдается? Объяснить полученный результат. Затем в одну пробирку добавить 1мл 1М Н2SO4, а в другую – такое же количество уксусной кислоты и тщательно перемешать. Отметить наблюдение, прилить в обе пробирки по 1мл 1М HCl и перемешать. Происходит ли растворение осадков? Почему? Указать, при добавлении каких реагентов происходят явления, перечисленные в названии данного опыта.
4. Осаждение сульфат-анионов. Влияние природы осадителя и растворителя на полноту осаждения. Приготовить насыщенный водный раствор сульфата кальция и разлить в 3 пробирки. В одну добавить равный объем раствора хлорида бария, а в другую – хлорида кальция (зачем?). Отметить наблюдение. Какой из катионов осаждает сульфат-ионы более полно? В третью пробирку прилить равный объем этилового спирта. Объяснить наблюдение, учитывая разную полярность молекул воды и спирта, а также то, что диэлектрическая проницаемость последнего (равная 25) значительно ниже, чем у воды (80).
5. Приготовление пересыщенного раствора. Наполнить 1/3 пробирки сухим ацетатом натрия и добавить 1 мл воды. В стакане с кипящей водой нагреть содержимое пробирки до полного растворения соли (следить, чтобы и на стенках не осталось кристалликов). Затем закрыть пробирку влажным тампоном (для чего?) и осторожно охладить до комнатной температуры. Образуется ли осадок?
Внести в пробирку кристаллик ацетата натрия. Что наблюдается? Зафиксировать тепловой эффект процесса (проба рукой). Объяснить наблюдаемые явления.
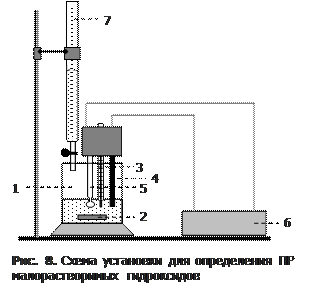 6. Определение значения ПР гидроксида магния (1 опыт на группу). Ознакомиться с правилами работы на рН-метре; включить его в сеть. Через 10–15 минут проверить правильность показаний прибора по буферным смесям с рН 1,68 и 9,18.
6. Определение значения ПР гидроксида магния (1 опыт на группу). Ознакомиться с правилами работы на рН-метре; включить его в сеть. Через 10–15 минут проверить правильность показаний прибора по буферным смесям с рН 1,68 и 9,18.
Собрать установку (рис. 8). В стакан (1) на 200 мл опустить магнитную мешалку (2) и налить 50 мл 0,1н хлорида магния. В раствор погрузить (на 2 см) термометр (3) и электроды (4 и 5) рН-метра (6). Бюретку (7) наполнить 1М щелочью.
Измерить рН исходного раствора в стакане, а затем, включив мешалку, определять рН, спустя минуту после каждого добавления щелочи. Вначале добавлять ее по каплям (до 0,5 мл суммарного объема, измеренного по бюретке), затем по 1,0 мл (до 4 мл) и, наконец, по 0,5 мл (до 7 мл).
На основании полученных данных построить кривую титрования хлорида магния щелочью в координатах «рН раствора – объем добавленной щелочи». Примерный ход кривой показан на рис. 9. Участок «аб» на этой кривой (с малым углом наклона) соответствует процессу осаждения гидроксида магния, а 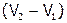 – объем щелочи, пошедшей на образование данного осадка. Объясните, почему в точках «а» и «б» резко изменяется характер зависимости рН от V добавляемой щелочи.
– объем щелочи, пошедшей на образование данного осадка. Объясните, почему в точках «а» и «б» резко изменяется характер зависимости рН от V добавляемой щелочи.
 Определив по графику значение рН, при котором
Определив по графику значение рН, при котором 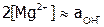 , рассчитать
, рассчитать 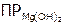 по формуле (как она получена?):
по формуле (как она получена?):
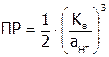 .
.
Сравнить найденное значение ПР с табличным. Объяснить возможное несовпадение этих величин.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 4228; Нарушение авторских прав?; Мы поможем в написании вашей работы!