
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей
|
|
|
|
Гидролиз, т.е. обменное взаимодействие ионов соли с молекулами воды, протекает в заметной степени, если его продуктом является хотя бы одно слабодиссоциирующее вещество: кислота или основание (механизм гидролиза данных процессов –[8]). Если оба образующихся электролита (и кислота, и основание) слабые, то гидролиз идет гораздо глубже. Это видно, в частности, по расчетной формуле константы гидролиза для данного случая:
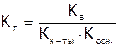 ,
,
где  и
и 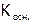 – константы диссоциации слабых кислот и оснований, являющихся продуктами гидролиза[34]. Очевидно, чем меньше значения
– константы диссоциации слабых кислот и оснований, являющихся продуктами гидролиза[34]. Очевидно, чем меньше значения  и
и 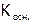 , тем больше величина
, тем больше величина  , и значит, в большей степени идет гидролиз.
, и значит, в большей степени идет гидролиз.
Степень гидролиза ( ) равна отношению количества соли, находящейся в растворе в гидролизованном состоянии, к общему ее количеству. Если при гидролизе происходит изменение рН среды (чаще всего это так), то на величину
) равна отношению количества соли, находящейся в растворе в гидролизованном состоянии, к общему ее количеству. Если при гидролизе происходит изменение рН среды (чаще всего это так), то на величину  влияет добавление кислоты или щелочи в соответствии с принципом Ле Шателье. Снижение же концентрации раствора, как правило, усиливает гидролиз, если он идет только по катиону или только по аниону [8].
влияет добавление кислоты или щелочи в соответствии с принципом Ле Шателье. Снижение же концентрации раствора, как правило, усиливает гидролиз, если он идет только по катиону или только по аниону [8].
Если гидролиз соли, образованной многозарядным катионом или анионом, протекает обратимо, то первая ступень гидролиза идет в значительно большей степени, чем вторая (и тем более чем третья). Поэтому продуктами гидролиза являются (главным образом) соответствующие оснóвные или кислые соли:
 ,
, 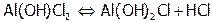 ,
,
 .
.
Способствует более полному протеканию гидролиза вывод продуктов из сферы реакции в виде осадка или газа или (тем более!) в виде и того, и другого. В последнем случае гидролиз может протекать необратимо, и тогда процесс отражают суммарным уравнением. Например  не существует в водных растворах, т.к. подвергается необратимому гидролизу (практически идет переосаждение с образованием менее растворимого вещества):
не существует в водных растворах, т.к. подвергается необратимому гидролизу (практически идет переосаждение с образованием менее растворимого вещества):
 .
.
То же наблюдается при гидролизе солей:  ,
,  ,
,  , в решетке которых связи менее прочны, чем в соответствующих гидроксидах. Напротив, сульфид висмута(III) гидролизу не подвергается, т.к. равновесная активность ионов
, в решетке которых связи менее прочны, чем в соответствующих гидроксидах. Напротив, сульфид висмута(III) гидролизу не подвергается, т.к. равновесная активность ионов  в растворе над осадком
в растворе над осадком 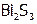 значительно меньше, чем над фазой
значительно меньше, чем над фазой  .
.
Иногда гидролиз идет практически необратимо до промежуточного продукта, если он достаточно малорастворим. Например, в случае  или
или  имеем:
имеем:
 ,
,  ,
,
затем:  , т.е. продукт второй ступени гидролиза образует осадок, и третья ступень практически не идет.
, т.е. продукт второй ступени гидролиза образует осадок, и третья ступень практически не идет.
При повышении температуры, если гидролиз является эндопроцессом, то он протекает глубже (в соответствии с принципом Ле Шателье). Например, степень гидролиза CrCl3 при 200С не превышает 5%, а при 800С составляет более 30%.
Рассмотрим на конкретном примере, как рассчитать значение  и рН раствора соли слабой кислоты, т.е. гидролизующейся по аниону, например, 0,1М КСN. Расчет проведем по методике решения задач, изложенной выше:
и рН раствора соли слабой кислоты, т.е. гидролизующейся по аниону, например, 0,1М КСN. Расчет проведем по методике решения задач, изложенной выше:
1. При растворении KCN в воде протекают следующие процессы:
а) 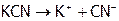 (необратимо), б)
(необратимо), б)  (обратимо).
(обратимо).
2. При гидролизе (уравнение (б) образуется щелочная среда, поэтому рН рассчитываем по формуле:  .
.
Количество соли, находящейся в растворе в гидролизованном состоянии, в соответствии с уравнением (б) равно количеству образовавшихся гидроксид-ионов, поэтому: 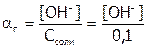 .
.
3. Для решения задачи обозначим 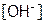 через Х моль/л.
через Х моль/л.
4. Ионы  получаются (в основном) в результате гидролиза (б), значит, их концентрацию нужно находить из выражения
получаются (в основном) в результате гидролиза (б), значит, их концентрацию нужно находить из выражения  (концентрация воды, как постоянная, входит в значение
(концентрация воды, как постоянная, входит в значение  ):
):
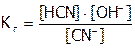 .
.
5. Поскольку молекулы HCN образуются при гидролизе KCN практически в том же количестве, что и  -ионы, то имеем:
-ионы, то имеем:  моль/л. Концентрация
моль/л. Концентрация 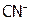 определяется диссоциацией соли по уравнению (а), и т.к. диссоциация идет практически нацело, то
определяется диссоциацией соли по уравнению (а), и т.к. диссоциация идет практически нацело, то  моль/л.
моль/л.
Однако из-за гидролиза часть этих ионов присутствует в растворе в виде молекул HCN. Причем для образования Х моль/л HCN затрачивается Х моль/л 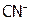 в соответствии с уравнением (б). Следовательно, равновесная концентрация
в соответствии с уравнением (б). Следовательно, равновесная концентрация 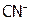 будет равна
будет равна  моль/л.
моль/л.
Значение 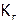 определяем по формуле:
определяем по формуле:  .
.
6. Подставим найденные значения и обозначения в выражение константы гидролиза:  [35]. Откуда:
[35]. Откуда:
 .
.
Значит: 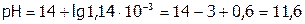 ;
;  .
.
Аналогично проводят расчеты для раствора соли слабого основания, например, NH4Cl (причем величину  рассчитывают по формуле:
рассчитывают по формуле:  ).
).
Проведем расчет[36] значений рН и  для соли слабого основания и слабой кислоты на примере 0,3М (NH4)2S, используя ту же методику решения.
для соли слабого основания и слабой кислоты на примере 0,3М (NH4)2S, используя ту же методику решения.
1. При растворении данной соли протекают следующие процессы:
а)  (необратимо),
(необратимо),
б) 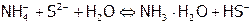 (обратимо)
(обратимо)
(это первая ступень гидролиза, вторая ступень идет в значительно меньшей степени, и ею при расчетах пренебрегаем),
в)  (обратимо),
(обратимо),
г) 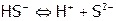 (обратимо)
(обратимо)
2. Для диссоциации 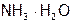 :
: 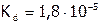 , а в случае
, а в случае  :
: 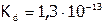 .
.
Значит, диссоциация гидрата аммиака с образованием 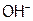 -ионов протекает в большей степени, чем гидросульфид-ионов с отщеплением
-ионов протекает в большей степени, чем гидросульфид-ионов с отщеплением 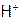 , поэтому среда будет щелочная, и рН рассчитываем по формуле:
, поэтому среда будет щелочная, и рН рассчитываем по формуле:  .
.
Поскольку количество соли, находящееся в растворе в гидролизованном состоянии, равно (в соответствии с уравнением (12)) числу молей 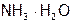 (или
(или  ), то:
), то:
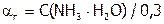 .[37]
.[37]
3. Пусть 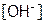 = Х моль/л, а
= Х моль/л, а 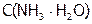 = Y моль/л.
= Y моль/л.
4. Ионы 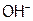 образуются (в основном) при диссоциации по уравнению (в), поэтому найдем их концентрацию из выражения
образуются (в основном) при диссоциации по уравнению (в), поэтому найдем их концентрацию из выражения 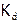 :
:
 .
.
Молекулы 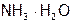 – продукт гидролиза (б), следовательно, их концентрацию нужно находить из выражения
– продукт гидролиза (б), следовательно, их концентрацию нужно находить из выражения  :
:
 .
.
5. Ионы аммония образуются при диссоциации  (нацело) по реакции (11) в количестве, равном 0,6 моль/л. Однако, в соответствии с уравнением (б), для получения Y моль/л
(нацело) по реакции (11) в количестве, равном 0,6 моль/л. Однако, в соответствии с уравнением (б), для получения Y моль/л 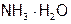 тратится Y моль/л
тратится Y моль/л  и, таким образом, в негидролизованном состоянии должно находиться
и, таким образом, в негидролизованном состоянии должно находиться 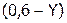 моль/л
моль/л 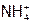 ; но в результате реакции (13) имеем дополнительно Х моль/л
; но в результате реакции (13) имеем дополнительно Х моль/л  (и столько же
(и столько же  -ионов). Следовательно:
-ионов). Следовательно:  моль/л, а
моль/л, а  .
.
В соответствии с уравнением (б) концентрация  равна [
равна [ 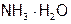 ], т.е. Y моль/л. При диссоциации нацело 0,3 моль/л исходной соли по уравнению (а) получается 0,3 моль/л сульфид-ионов, но для образования Y моль/л
], т.е. Y моль/л. При диссоциации нацело 0,3 моль/л исходной соли по уравнению (а) получается 0,3 моль/л сульфид-ионов, но для образования Y моль/л  расходуется Y моль/л
расходуется Y моль/л  , значит, в растворе должно присутствовать
, значит, в растворе должно присутствовать  моль/л
моль/л  . Однако при диссоциации
. Однако при диссоциации  по уравнению (г) дополнительно получаются ионы
по уравнению (г) дополнительно получаются ионы  в количестве, которое обозначим через Z. И тогда
в количестве, которое обозначим через Z. И тогда  , а
, а  . Значение
. Значение 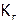 рассчитываем по формуле:
рассчитываем по формуле:
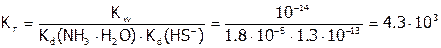 .
.
6. Подставляя все обозначения и величины в выражения Кd и Кг, получим:
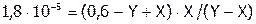
 .
.
Если пренебречь значениями Х и Z, как слагаемыми, то имеем:
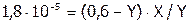 ,
,
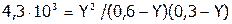 .
.
Решая квадратное уравнение, найдем:  и
и  .
.
Очевидно, Y1 не удовлетворяет решению задачи, т.к. из 0,3 моль S2- даже при полном гидролизе соли не может получиться 0,601 моль  , следовательно:
, следовательно:  и
и  .
.
Подставляя найденное значение Y в предидущее уравнение, получим:
 , а
, а  .
.
ЛАБОРАТОРНАЯ РАБОТА «Гидролиз солей»
1. Влияние природы ионов соли на степень гидролиза
а) Обратимый гидролиз. Определить с помощью универсальной индикаторной бумаги pH растворов одинаковой молярной концентрации солей: NaCl, AlCl3, CH3COONa, Na2CO3, Na2SO3, CH3COONH4, (NH4)2CO3. Расположить соли в ряд увеличения pH их растворов, объяснить относительное положение в этом ряду солей с одноименными ионами и сделать общий вывод.
б) Практически необратимый гидролиз. В две пробирки налить, соответственно, по 1 мл 1М растворов солей алюминия и железа(II) и добавить равные объемы 1М карбоната натрия. Что происходит? Чем объясняется различный состав продуктов гидролиза? Как доказать это различие? Какая соль гидролизуется необратимо?
2. Смещение равновесия гидролиза
а) Влияние концентрации раствора. К четырем каплям хлорида сурьмы(III) добавить 2 мл дистиллированной воды. Что наблюдается? Написать уравнения гидролиза исследуемой соли по двум ступеням и выражение  для суммарного процесса.
для суммарного процесса.
Добавление каких ионов может сместить равновесие гидролиза в обратную сторону? Как можно снова усилить гидролиз? Ответы проверьте на практике.
б) Влияние температуры. В одной пробирке к раствору ацетата натрия добавить 2 капли фенолфталеина (отметить цвет раствора), а во вторую налить 0,1М хлорид железа(III) и отметить его окраску. Затем обе пробирки нагреть на водяной бане в течение 10 мин. Что наблюдается и почему?
3. Определение  и
и  солей (1 опыт на группу). Включить рН-метр в сеть и через 10 минут проверить его по буферам 1,68 и 9,18. Провести по 2 измерения рН деци-, санти-, и миллимолярных растворов карбоната и ацетата натрия. Рассчитать
солей (1 опыт на группу). Включить рН-метр в сеть и через 10 минут проверить его по буферам 1,68 и 9,18. Провести по 2 измерения рН деци-, санти-, и миллимолярных растворов карбоната и ацетата натрия. Рассчитать  и
и  для каждого раствора по усредненным данным опыта (практические значения), а также рассчитать pH,
для каждого раствора по усредненным данным опыта (практические значения), а также рассчитать pH,  ,
, 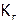 , используя справочные данные (теоретические значения) и представить результаты в виде таблицы:
, используя справочные данные (теоретические значения) и представить результаты в виде таблицы:
| Соль | Концентрация | Практические значения | Теоретические значения | ||||
| рН | 
| 
| рН | 
| 
| ||
| Na2СО3 | 0,1 0,01 0,001 | ||||||
| CH3COONa | 0,1 0,01 0,001 |
Объяснить возможные расхождения. Влияет ли разбавление на  и
и  ? Какая формула связывает
? Какая формула связывает  и концентрацию соли.
и концентрацию соли.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 1254; Нарушение авторских прав?; Мы поможем в написании вашей работы!