
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коллоидные растворы
|
|
|
|
Вопросы к семинару
1. Написать выражения констант гидролиза и рассчитать 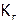 солей: NH4Cl, Ca(CH3COO)2, (NH4)2SO3. Какая из них сильнее гидролизуется?
солей: NH4Cl, Ca(CH3COO)2, (NH4)2SO3. Какая из них сильнее гидролизуется?
2. Одинакова ли величина  цианида калия при концентрациях 1,0 и 0,001 моль/л? (Показать расчетом.) Как усилить или ослабить гидролиз?
цианида калия при концентрациях 1,0 и 0,001 моль/л? (Показать расчетом.) Как усилить или ослабить гидролиз?
3. Почему растворы сульфата цинка и дихромата калия имеют слабокислую среду? Меняются ли значение рН при добавлении к ним хлорида бария? Почему?
4. Каждому студенту написать ионные и молекулярные уравнения гидролиза одной из солей:
(1) (NH4)2СO3, (7) NH4Cl, (13) Rb2S,
(2) Na3PO4, (8) CH3COONH4, (14) CaSO4,
(3) Al2S3, (9) KNO3 (15) 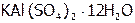 ,
,
(4) K2S (10) KCN, (16) NaAlO2.
(5) Cr2(CO3)3, (11) CuSO4,
(6) NaF, (12) Ba(NO3)2,
Куда сместится равновесие гидролиза при добавлении к раствору соли следующих веществ: HCl? NaOH? NaAlO2? NH4Cl? NaCl?
Коллоидные растворы (золи) по размеру своих частиц (т.н. мицелл) занимают промежуточное положение между истинными растворами, в которых растворенное вещество находится в виде ионов или молекул (размеры этих частиц обычно не более 1 нм), и суспензиями (твердое в жидком) или эмульсиями (жидкое в жидком), в которых размерычастиц растворенного вещества более 100 нм.
Золи, как и истинные растворы, проходят через бумажный фильтр и кинетически устойчивы (т.е. не разрушаются под действием силы тяжести), однако коллоидные растворы рассеивают свет (эффект Тиндаля).
Согласно современным представлениям золи являются микрогетерогенными системами, т.е. двухфазными, но со столь малым размером частиц растворенной фазы, что они не видны человеческим глазом. Благодаря высокой степени дисперсности этой фазы, и, как следствие, чрезвычайно большой величине ее удельной поверхности, для золей характерна значительная способность к адсорбции (концентрированию ионов или молекул раствора на поверхности мицелл).
Строение мицеллы, например золя гидроксида железа(III) схематически можно представить следующим:







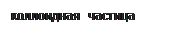

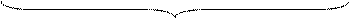
Основу мицеллы составляет микроскопический кусочек вещества (образующего коллоидный раствор), который называется ядром и в данном примере условно обозначен 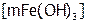 . Благодаря наличию свободных валентностей на поверхности ядра, оно адсорбирует (т.е. поглощает своей поверхностью) ионы из раствора, причем преимущественно те, которые близки по природе составу ядра.
. Благодаря наличию свободных валентностей на поверхности ядра, оно адсорбирует (т.е. поглощает своей поверхностью) ионы из раствора, причем преимущественно те, которые близки по природе составу ядра.
Например, если золь гидроксида железа(III) получается гидролизом хлорида железа(III) при нагревании его сильноразбавленного раствора по реакции:
 ,
,
то в растворе имеются в достаточном количестве 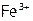 ,
, 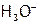 и
и 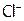 . Однако на поверхности ядра адсорбируются преимущественно
. Однако на поверхности ядра адсорбируются преимущественно 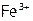 , сообщая частице положительный заряд (поэтому такие ионы называются потенциалобразующими).
, сообщая частице положительный заряд (поэтому такие ионы называются потенциалобразующими).
Заряженная частица притягивает из раствора в свой поверхностный слой ионы противоположного знака (противоионы), в нашем примере – анионы хлора.
В поверхностном слое различают адсорбционный слой (слой Гельмгольца) и диффузионный (слой Гуи). Адсорбционный прочно связан с ядром и перемещается вместе с ним, составляя коллоидную частицу. Ее заряд (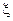 -потенциал) определяется алгебраической суммой зарядов потенциалобразующих ионов и противоионов адсорбционного слоя. В нашем случае частица золя имеет заряд равный +(
-потенциал) определяется алгебраической суммой зарядов потенциалобразующих ионов и противоионов адсорбционного слоя. В нашем случае частица золя имеет заряд равный +(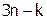 ).
).
Диффузионный слой (он формируется в результате диффузии противоионов в фазу растворителя) имеет меньшую концентрацию ионов, чем адсорбционный, и более подвижен относительно ядра мицеллы (т.е. от адсорбционного слоя его отделяет т.н. линия скольжения). Коллоидная частица и диффузионный слой вместе образуют электронейтральную систему – мицеллу. Отметим условность приведенной схемы, поскольку в ней не отражен, в частности, тот факт, что адсорбционные и диффузионные слои содержат ионы и молекулы растворителя. Устойчивость коллоидных растворов объясняется тем, что их частицы имеют одинаковые по знаку заряды. Это обусловливает их взаимное отталкивание. Сближению коллоидных частиц препятствуют также сольватные оболочки их ионов в поверхностном слое.
Под действием электронапряжения, благодаря 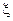 -потенциалу коллоидных частиц, наблюдаются электрофорез (перемещение к электроду противоположного знака) и электроосмос (перемещение жидкости, которая оказывается заряженной из-за наличия диффузионного слоя, относительно коллоидных частиц).
-потенциалу коллоидных частиц, наблюдаются электрофорез (перемещение к электроду противоположного знака) и электроосмос (перемещение жидкости, которая оказывается заряженной из-за наличия диффузионного слоя, относительно коллоидных частиц).
Коагуляция коллоидных растворов. Коагуляция – это укрупнения коллоидных частиц из-за их агрегации (соединения друг с другом) с последующим оседанием (т.н. седиментация). Коагуляцию золя можно вызвать, например, нагреванием, центрифугированием, но чаще используют добавление электролитов.
При их добавлении противоионы диффузионного слоя переходят частично в адсорбционный, снижая заряд коллоидной частицы. Кроме того, добавляемый электролит, благодаря собственной сольватации, частично разрушает сольватную оболочку мицелл. В результате чего взаимное отталкивание коллоидных частиц снижается настолько, что происходит коагуляция.
Минимальная концентрация электролита, при которой наступает этот процесс, называется порогом коагуляции. Причем, чем выше заряд иона-коагулянта (т.е. имеющего заряд, противоположный по знаку заряду коллоидной частицы), тем ниже при прочих равных условиях порог коагуляции. (Однако следует отметить сильное коагулирующее действие однозарядных ионов водорода.)
Порог коагуляции зависит также от скорости добавления электролита, от интенсивности перемешивания раствора и, кроме того, может резко изменяться при совместном действии электролитов. Коагуляция наблюдается и при смешивании золей, имеющих противоположные знаки коллоидных частиц. Такая взаимная коагуляция часто используется для определения знака 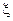 -потенциала.
-потенциала.
Иногда требуется защита коллоидных растворов от коагуляции, для этого используют т.н. защитные коллоиды, т.е. поверхностно-активные вещества (ПАВ). К ним относятся, например, крахмал и желатин. Действие ПАВ заключается в том, что, адсорбируясь на поверхности мицелл, они снижают свободную энергию данной системы, тем самым стабилизируя поверхность раздела фаз.
Способы получения коллоидных растворов. Коллоидные растворы можно получать двумя противоположными путями: или диспергированием (раздроблением крупных частиц вещества на частицы размером менее 100нм); или конденсацией (агрегацией молекул или ионов в более крупные частицы).
Диспергирование проводят или механически (на специальных коллоидных мельницах), или электрическим распылением (при возникновении электродуги между электродами диспергируемого материала), или переведением в раствор коагулированной дисперсной фазы. Последний процесс называется пептизацией (он противоположен коагуляции). Пептизацию можно осуществлять с помощью ПАВ или диализом (т.е. отмыванием осадка от электролита, вызвавшего коагуляцию).
Конденсационные методы различают физические и химические. В основе последних лежат реакции, приводящие к получению малорастворимых веществ. Для получения коллоидного раствора эти реакции проводят или в присутствии вещества, стабилизирующего коллоидное состояние, или при сильном разбавлении реагентов. Например, взаимодействием разбавленных растворов 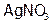 и NaCl синтезируют золь хлорида серебра. Можно получить коллоидную серу, проводя в воде реакцию:
и NaCl синтезируют золь хлорида серебра. Можно получить коллоидную серу, проводя в воде реакцию:
 .
.
Золи гидроксидов многозарядных ионов получают гидролизом (см. выше).
Физические методы основаны, например, на конденсации вещества из газообразного состояния. Можно также использовать метод замены растворителя. При этом истинный раствор вещества в одной жидкости медленно добавляют к другой, в котором хорошо растворяется первый растворитель, но малорастворимо вещество. Поэтому оно выделяется в виде золя (опыт 2 в лабораторной работе).
ЛАБОРАТОРНАЯ РАБОТА
«Коллоидные растворы»
1. Получение эмульсии масла в воде. Налить в пробирку 1 мл воды, добавить 8 капель растительного масла, закрыть пробкой и сильно встряхнуть. Устойчива ли образовавшаяся эмульсия двух жидкостей? Добавить в пробирку 8 капель 1%-го раствора мыла и опять сильно встряхнуть ее. Объяснить наблюдение. Какую роль выполняют молекулы мыла в данном опыте?
2. Получение золя серы. К 0,5 г серы (в пробирке) прилить 1 мл этилового спирта. Энергично взбалтывать содержимое пробирки в течение 15 минут (при этом образуется насыщенный раствор серы в спирте). Часть приготовленного раствора с помощью пипетки осторожно по каплям при перемешивании добавить к 5 мл воды. Каков внешний эффект?
Отобрать по 0,5 мл полученного золя в две пробирки, затем в одну прилить 0,5 мл воды, в другую – 0,5 мл раствора хлорида бария и обе пробирки нагреть на водяной бане. Что происходит? Почему?
3. Получение и исследование золя гидроксида железа(III).
а). Синтез. В конической колбе нагреть до кипения 40 мл воды и добавить к ней по каплям при постоянном перемешивании 4 мл 1%-го хлорида железа(III). Полученный раствор прокипятить в течение 8–12 мин. Что наблюдается? Почему? Написать уравнение реакции и изобразить схему мицеллы гидроксида железа. Золь сохранить для опытов «б» и «в».
б). Определение знака заряда коллоидной частицы методом капиллярного анализа. Метод основан на том, что поверхность фильтровальной бумаги при погружении в воду заряжается отрицательно, поэтому при движении воды вверх по полоске бумаги (под действием капиллярных сил) отрицательно заряженные коллоидные частицы будут перемещаться вверх вместе с водой, а положительно заряженные свяжутся бумагой и выше подниматься не будут.
В стакан на 100 мл налить 20 мл приготовленного золя гидроксида железа(III), добавить краситель (лакмус, конго красный или метиленовый синий) и опустить в раствор край полоски фильтровальной бумаги. Через час сравнить высоту подъема по бумаге воды (с красителем) и гидроксида железа(III). Какой знак заряда частиц?
в). Коагуляциязоля гидроксида железа(III). Налить в 6 пробирок по 2 мл золя, полученного в опыте «а», и добавить в каждую пробирку по 2 мл 0,1н растворов соответственно NaCl, BaCl2, AlCl3, Na2SO4 и NaH2PO4. Что наблюдается? Как зависят коагулирующие свойства электролита от знака и величины заряда его ионов? (Как вызвать пептизацию осадка?). Повторить опыт коагуляции дигидрофосфатом натрия, но предварительно добавить в коллоидный раствор гидроксида железа(III) 5 капель 0,5%-го раствора желатина. Объяснить наблюдение.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 1739; Нарушение авторских прав?; Мы поможем в написании вашей работы!