
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексные соединения
|
|
|
|
Вопросы к семинару
1. Определение гальванического элемента. Написать каждому студенту схему ГЭ, работающего на основе одной из реакций:
(1) 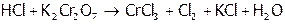 ,
,
(2) 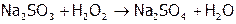 ,
,
(3) 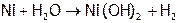 ,
,
(4) Концентрационного элемента на основе 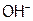 ,
,
(5) 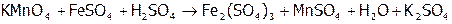 ,
,
(6) 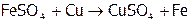 ,
,
(7) 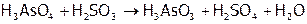 ,
,
(8)  ,
,
(9) 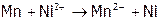 ,
,
(10) Концентрационного элемента на основе 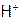 ,
,
(11) 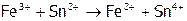 ,
,
(12) 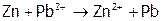 ,
,
(13) Концентрационного элемента на основе 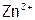 ,
,
(14) 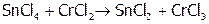 ,
,
(15) 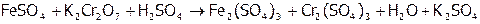 ,
,
(16) Концентрационного элемента на основе  .
.
2. Определение электролиза. Написать каждому студенту реакции, протекающие при электролизе расплава и водного раствора одного из веществ:
(1) 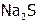 , (2)
, (2) 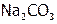 , (3)
, (3) 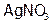 , (4) KF, (5)
, (4) KF, (5) 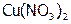 , (6) HCl, (7)
, (6) HCl, (7) 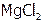 , (8) KI, (9)
, (8) KI, (9) 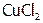 , (10)
, (10) 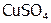 , (11)
, (11) 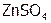 , (12)
, (12) 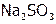 , (13) NaOH, (14)
, (13) NaOH, (14) 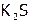 , (15)
, (15) 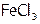 , (16) KOH.
, (16) KOH.
Комплексными соединениями (КС) называют вещества, имеющие в узлах кристаллической решетки агрегаты атомов (комплексы), способные к самостоятельному существованию в растворе. Комплекс состоит из центрального атома (ц.а.), т.е. комплексообразователя (чаще это ион металла), и окружающих его лигандов (они обозначаются буквой L – обычно это ионы или нейтральные молекулы).
Комплекс называют также внутренней сферой КС. В ней частицы удерживаются вместе преимущественно ковалентными связями, поэтому она диссоциирует по типу слабого электролита. Чтобы это подчеркнуть, внутреннюю сферу заключают в квадратные скобки, например: 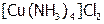 .
.
Частицы за скобками (в нашем примере это 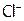 -ионы) составляют внешнюю сферу КС (их число определяется зарядом комплекса), они связаны с внутренней сферой ионной связью и потому диссоциация с их отщеплением идет нацело.
-ионы) составляют внешнюю сферу КС (их число определяется зарядом комплекса), они связаны с внутренней сферой ионной связью и потому диссоциация с их отщеплением идет нацело.
Изомерия комплексных соединений. Если в состав КС входят разные лиганды, то возможно явление изомерии, т.е. существование разновидностей, одинаковых по составу, но различающихся по строению или расположению L в пространстве, и, как следствие, по химическим и физическим свойствам. Указанные разновидности называются изомерами. Выделяют следующие виды изомерии:
1) ионизационная, при которой наблюдается неодинаковое распределение L между внутренней и внешней сферами КС:
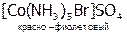 и
и 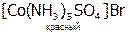 .
.
Частным случаем ионизационной изомерии является гидратная, т.е. различное распределение молекул воды между внутренней и внешней сферами:
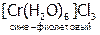 ,
, 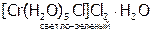 ,
, 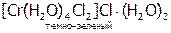
Эти соединения легко различить по количеству ионов хлора, осаждаемых нитратом серебра в расчете на один моль хрома. Для первого КС это количество равно 3, для второго – 2, для третьего – 1.
2) изомерия связи. Она имеет место в случае амбидентантных лигандов, т.е. монодентантных L с двумя донорными атомами [8]: 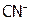 , NO,
, NO,  и др., поэтому они могут координировать с ц.а. различно. Например, координация
и др., поэтому они могут координировать с ц.а. различно. Например, координация 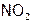 возможна или атомом азота:
возможна или атомом азота: 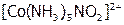 – нитро-комплекс (желто-коричневый), или атомом кислорода:
– нитро-комплекс (желто-коричневый), или атомом кислорода: 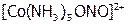 – нитрито-комплекс (розовый).
– нитрито-комплекс (розовый).
3) координационная изомерия. Она наблюдается в случае КС, содержащих два комплексообразователя. Проявляется в различном их распределении между катионом и анионом: 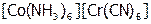 и
и 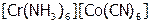 .
.
4) пространственная (геометрическая) изомерия. В этом случае изомеры отличаются пространственным размещением L во внутренней сфере КС. Как, например, при цис-транс-изомерии, которая имеет место, главным образом, в октаэдрических и квадратных комплексах. Например:
 |
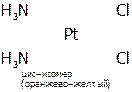
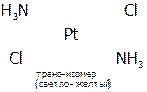 .
.
(Иногда донорно-акцепторные связи в графических формулах изображают пунктиром или стрелкой, направленной от атома-донора к атому-акцептору, в нашем примере направление было бы от атома N (молекулы аммиака) к Pt.)
Кроме перечисленных есть и другие виды изомерии.
Номенклатура КС. В русском языке при названии КС (как и в случае солей) вначале указывают анионную часть, потом катионную. Напомним, что название внутренней сферы (т.е. комплекса) начинают с перечня лигандов (их названия – в табл. 2.) справа налево, указывая греческими числительными число одинаковых L. Например, K2[Be(SO4)2] – дисульфатобериллат калия; [Pt(C2H4)(NH3)4]Cl2 – дихлорид тетраамминэтиленплатины (II), [Pt(C2H4)(NH3)2Cl2] – дихлородиамминэтиленплатина.
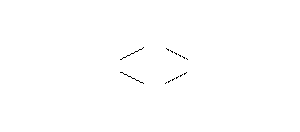 Если греческие числительные уже использованы в названии лиганда, то перед его названием (заключенным в скобки) ставят латинские числительные (бис-, трис-, тетракис- и т.д.). Иногда в случае многоядерных комплексов (т.е. имеющих более одного ц.а.) перед названием лигандов, выполняющих функцию мостиков между двумя центральными атомами, ставится греческая буква m. Например, вещество:
Если греческие числительные уже использованы в названии лиганда, то перед его названием (заключенным в скобки) ставят латинские числительные (бис-, трис-, тетракис- и т.д.). Иногда в случае многоядерных комплексов (т.е. имеющих более одного ц.а.) перед названием лигандов, выполняющих функцию мостиков между двумя центральными атомами, ставится греческая буква m. Например, вещество:
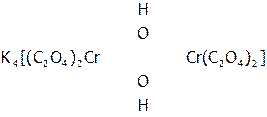
называется ди- 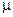 -гидроксотетраоксалатодихроматом(III) калия
-гидроксотетраоксалатодихроматом(III) калия
Устойчивость комплексных соединений. Термодинамически процесс комплексообразования характеризуется (по правилам ИЮПАК) константой равновесия, которая называется константой устойчивости комплекса (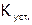 ). Например, для процесса формирования роданидного комплекса железа(III):
). Например, для процесса формирования роданидного комплекса железа(III):
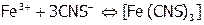 ,
, 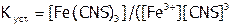 ).
).
Чем больше величина 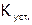 , тем прочнее комплекс, т.е. тем в большей степени равновесие комплексообразования смещено вправо.
, тем прочнее комплекс, т.е. тем в большей степени равновесие комплексообразования смещено вправо.
На практике для характеристики прочности внутренней сферы пользуются также константой нестойкости (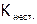 ), которая является величиной, обратной
), которая является величиной, обратной 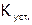 (т.е.
(т.е. 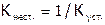 ), и определяет диссоциацию комплекса:
), и определяет диссоциацию комплекса:
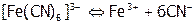 .
.
Очевидно, чем меньше величина 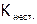 , тем прочнее комплекс. Например, для соединения
, тем прочнее комплекс. Например, для соединения 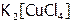 константа нестойкости внутренней сферы близка к единице, следовательно, в его растворе существуют свободные ионы (
константа нестойкости внутренней сферы близка к единице, следовательно, в его растворе существуют свободные ионы ( и
и 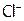 ) и комплексы (
) и комплексы ( ) в сопоставимых количествах. Поэтому такие вещества часто записывают по типу двойных солей:
) в сопоставимых количествах. Поэтому такие вещества часто записывают по типу двойных солей: 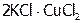 . Двойные соли в отличие от КС полностью диссоциируют на ионы при растворении в воде, например:
. Двойные соли в отличие от КС полностью диссоциируют на ионы при растворении в воде, например:
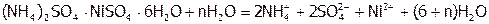 .
.
Для комплекса же 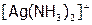 величина
величина 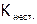 низка (9,3.10-8), это означает, что концентрация свободных частиц
низка (9,3.10-8), это означает, что концентрация свободных частиц 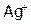 и NH3 незначительна по сравнению с концентрацией комплексных ионов.
и NH3 незначительна по сравнению с концентрацией комплексных ионов.
Отметим, что диссоциация комплексов идет ступенчато. Например:
 , К нест.1 =9,3.10-4
, К нест.1 =9,3.10-4
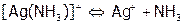
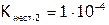 .
.
(Приведенные уравнения являются формальными, ибо в действительности идут процессы эквивалентного замещения 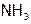 на молекулы воды.) Произведение констант нестойкости последовательных ступеней диссоциации дает полную константу нестойкости данного комплекса:
на молекулы воды.) Произведение констант нестойкости последовательных ступеней диссоциации дает полную константу нестойкости данного комплекса: 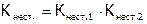 .
.
Отметим, что, как правило, чем больше заряд ц.а. и меньше его радиус, тем меньше 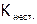 , т.е. выше прочность комплекса (см. табл. 13).
, т.е. выше прочность комплекса (см. табл. 13).
Таблица 13. Зависимость 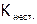 комплекса от заряда ц.а. и его радиуса (r).
комплекса от заряда ц.а. и его радиуса (r).
| Комплекс | r, А | Кнест. |
| [Mg(OH)]+ [Al(OH)]2+ [BeF]+ [MgF]+ | - - 0,34 0,75 | 2,5 · 10 -3 1,38 · 10 -9 5,1· 10 -5 5,0 · 10 -2 |
Реакции КС. Величины 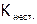 или
или 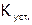 , характеризующие комплексообразование, могут использоваться для расчета равновесия реакций, идущих с участием комплексов, если они протекают внутрисферно. Это следующие процессы:
, характеризующие комплексообразование, могут использоваться для расчета равновесия реакций, идущих с участием комплексов, если они протекают внутрисферно. Это следующие процессы:
а). Реакции, идущие с изменением состава внутренней сферы: присоединение – увеличение координационного числа[42] (к.ч.), элиминирование – уменьшение к.ч., замещение одних лигандов другими.
Отметим, что при замещении равновесие, подчиняясь общим закономерностям, смещено в сторону образования менее диссоциированного комплекса, т.е. более термодинамически устойчивого. Например, процесс:
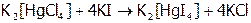 ,
,
идет преимущественно вправо, что можно объяснить, исходя из значений констант:
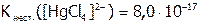 ,
, 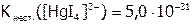 .
.
Реакции замещения могут идти через образование промежуточного соединения с меньшим к.ч. (диссоциативный механизм замещения – Д) или с большим к.ч. (ассоциативный механизм – А):
Д: 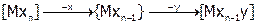 ;
;
А: 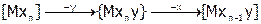 ;
;
Подчеркнем, что замещение в комплексах с к.ч.=4 чаще идет по ассоциативному механизму, а с к.ч.=6, как правило, по диссоциативному механизму, т.к. для большинства элементов к.ч. 3 и 7 менее характерны, чем 4, 5 и 6.
б). Реакции, в результате которых изменяется ст.ок. элементов комплекса.
(1) ОВР с ц.а. Особенностью их протекания является то, что перенос электронов осуществляется через лиганд, выступающий в качестве мостика между восстановителем и окислителем. Отметим, что комплексование часто стабилизирует ту или иную ст.ок. ц.а. Так, Е0(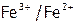 ) = 0,77 В, а Е0(
) = 0,77 В, а Е0(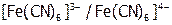 ) = 0,36В, т.е. цианид-ионы стабилизируют железо в ст.ок. (+3).
) = 0,36В, т.е. цианид-ионы стабилизируют железо в ст.ок. (+3).
Отсюда понятно, почему иодная вода (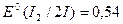 B) не окисляет
B) не окисляет 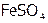 , но легко переводит желтую кровяную соль в красную:
, но легко переводит желтую кровяную соль в красную:
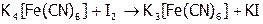 .
.
(2) ОВР с L. При их протекании меняется ст.ок. элемента, находящегося в составе лиганда. Если в реакцию такого типа вступает временно присоединяющийся L, то ее относят к каталитическим процессам. В частности, биологическое связывание N2 происходит в результате того, что комплекс железа и молибдена (составная часть фермента нитрогеназы) активирует координированную молекулу азота, поляризуя ее, и поэтому при контакте последней с водородом оказывается возможным их взаимодействие при об.у. с образованием, например, аммиака.
в). Реакции разрушения КС. Они идут в тех случаях, когда ц.а. или L при действии добавляемых реагентов связываются в соединения, более устойчивые по сравнению с комплексом.
Для КС возможны также внешнесферные реакции – при их осуществлении комплексы остаются неизменными. К ним относятся ОВР или реакции обмена (процессы осаждения, нейтрализации и т.п.), протекающие с участием частиц только внешней сферы. Например:
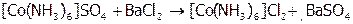 .
.
ЛАБОРАТОРНАЯ РАБОТА «Получение и свойства КС»
ПРИМЕЧАНИЕ. При оформлении отчета привести уравнения всех проведенных реакций (указать, к какому типу они относятся) в молекулярном и сокращенном ионном виде, дать названия комплексных соединений, фигурирующих в них.
1). Изомерия комплексных соединений. Несколько кристаллов хлорида хрома(III) растворить в минимальном количестве воды. Отметить цвет полученного раствора (какие частицы обеспечивают окраску?) и разделить его на две пробирки. Одну оставить в качестве контрольной, а вторую нагреть на водяной бане до изменения цвета раствора. Можно ли объяснить изменение окраски с позиции ТКП?
2. Сравнение устойчивости циклических и нециклических КС
а) Получение нециклического КС никеля(II). К 0,5 мл соли никеля(II) добавлять по каплям концентрированный аммиак до растворения выпадающего вначале осадка (какого цвета?). Отметить окраску раствора и сохранить его для опыта «в».
б) Получение циклического комплекса никеля(II). К 2 каплям раствора соли никеля в пробирке добавить 4 капли реактива Чугаева (раствора смеси аммиака и диметилглиоксима С4Н6(NOH)2). Что наблюдается? Полученный раствор диметилглиоксимата никеля:
 |
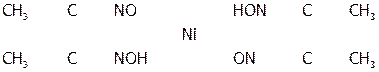
сохранить для опыта «в». Почему в данных условиях не образуется аммиачное КС?
Сравнить цвета комплексов, синтезированных по пунктам «а» и «б» и окраску исходного раствора соли никеля(II). Можно ли объяснить различие с позиции ТКП?
в). Сравнение устойчивости. К исходному раствору соли никеля(II) и к растворам, полученным в опытах «а» и «б» (отобрав их по 6 капель в разные пробирки), добавить по 4 капли 2М NaOH. Что наблюдается? Почему? Используя справочные данные, рассчитать концентрацию 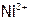 в водном растворе над осадком гидроксида никеля(II) и в 0,1М растворе аммиачного комплекса никеля(II), если
в водном растворе над осадком гидроксида никеля(II) и в 0,1М растворе аммиачного комплекса никеля(II), если 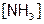 равна 1 моль/л. Сделать вывод. Согласуется ли он с результатами данного опыта.
равна 1 моль/л. Сделать вывод. Согласуется ли он с результатами данного опыта.
3. Влияние на устойчивость комплекса:
а) природы комплексообразователя и природы аниона внешней сферы. Получить хлорид серебра, добавив к 10 каплям нитрата серебра 20 капель хлорида натрия. Отделить осадок от раствора (центрифугированием) и добавить к нему по каплям 10%-ый аммиак при тщательном перемешивании до растворения, не больше! Полученный раствор разделить на 3 пробирки. В одну добавить 4 капли сульфата никеля(II). (Что происходит и почему?[43]). В другую – раствора бромида натрия, в третью – иодида калия. Отметить наблюдаемые явления и дать им объяснения, используя справочные величины ПР соответствующих галидов серебра (табл. 12) и значение констант нестойкости[44] ионов 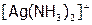 и
и 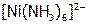 .
.
Помните! Все растворы и осадки, содержащие серебро, сливать в специальную банку, приготовленную препаратором!
б) природы лиганда. 0,3 г безводной соли сульфата меди (отметить ее цвет) растворить в 6 мл воды. (Наличие каких ионов обеспечивает появившуюся окраску?) Половину полученного раствора распределить в 4 пробирки, а ко второй половине добавить по каплям и при перемешивании концентрированный аммиак до растворения образующегося вначале осадка 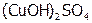 (каков его цвет?). Отметить окраску раствора. Наличие каких ионов ее обеспечивает? Полученный раствор разлить тоже в 4 пробирки, но другого ряда. В первые пробирки обоих рядов добавить по 6 капель хлорида бария, во вторые – по 2 капли 2М щелочи, в третьи – по 6 капель 1М серной кислоты, а в четвертые – по 4 капли сульфида натрия. Отметить наблюдаемые внешние эффекты, объяснить их и сделать вывод о сравнительной устойчивости гидратных и аммиачных комплексов меди(II). Почему сульфид-ионы в отличие от гидроксид-ионов разрушают оба комплекса?
(каков его цвет?). Отметить окраску раствора. Наличие каких ионов ее обеспечивает? Полученный раствор разлить тоже в 4 пробирки, но другого ряда. В первые пробирки обоих рядов добавить по 6 капель хлорида бария, во вторые – по 2 капли 2М щелочи, в третьи – по 6 капель 1М серной кислоты, а в четвертые – по 4 капли сульфида натрия. Отметить наблюдаемые внешние эффекты, объяснить их и сделать вывод о сравнительной устойчивости гидратных и аммиачных комплексов меди(II). Почему сульфид-ионы в отличие от гидроксид-ионов разрушают оба комплекса?
в) ионной силы раствора. Налить в пробирку по 1 мл хлорида железа и роданида аммония. Отметить интенсивность окраски полученного раствора. Разделить его на 3 пробирки. Первую оставить для сравнения, во вторую насыпать лопаточку хлорида аммония, а в третью – сульфата калия. Отметить изменение интенсивности окраски растворов, объяснить происходящие явления.
г) природы растворителя. Смешать в пробирке по 8 капель насыщенных растворов хлорида кобальта(II) и роданида аммония. Отметить цвет раствора. Разделить его на две пробирки. В одну добавить 6 капель амилового спирта, в другую – 12 капель воды и тщательно перемешать. Объяснить наблюдаемые явления.
Рассчитать концентрацию ионов кобальта в водном растворе, одномолярном по роданиду аммония и по роданидному КС: 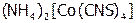 , если
, если 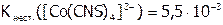 . Отметить, к какому типу соединений (комплексных или двойных солей) можно отнести полученное вещество по отношению к воде. А по отношению к амиловому спирту?
. Отметить, к какому типу соединений (комплексных или двойных солей) можно отнести полученное вещество по отношению к воде. А по отношению к амиловому спирту?
4. Процессы, протекающие без разрушения комплекса
а). Цианидные комплексы железа.
(1) К 2 каплям раствора желтой кровяной соли 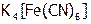 добавить 3 капли раствора сульфата меди(II). Отметить и объяснить внешний эффект реакции.
добавить 3 капли раствора сульфата меди(II). Отметить и объяснить внешний эффект реакции.
(2) Прибавлять (по каплям и при перемешивании) раствор желтой кровяной соли 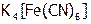 к кристаллику иода в пробирке до полного его растворения. Как доказать, что при этом произошла ОВР?
к кристаллику иода в пробирке до полного его растворения. Как доказать, что при этом произошла ОВР?
(3) К 4 каплям раствора иодида калия добавить по 3 капли 2М HCl, бензина и раствора красной кровяной соли 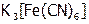 . Тщательно перемешать, дождаться расслоения жидкостей. Изменилась ли окраска слоя бензина? Почему?
. Тщательно перемешать, дождаться расслоения жидкостей. Изменилась ли окраска слоя бензина? Почему?
б). Аквакомплексы железа. Повторить опыты (2) и (3), взяв вместо желтой и красной кровяных солей соответственно растворы соли Мора и хлорида железа(III).
Рассчитать  проведенных процессов и сделать выводы. Можно ли снижение ОВП, наблюдаемое при переходе от аквакомплексов железа(II) и (III) к их цианидным комплексам, объяснить с позиции ТКП?
проведенных процессов и сделать выводы. Можно ли снижение ОВП, наблюдаемое при переходе от аквакомплексов железа(II) и (III) к их цианидным комплексам, объяснить с позиции ТКП?
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 1125; Нарушение авторских прав?; Мы поможем в написании вашей работы!