
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопросы к коллоквиуму II
|
|
|
|
1. Доказательства сложного строения атома. Планетарная модель атома. Квантование энергии. Формула Планка. Волновые свойства микрочастиц. Уравнение Де-Бройля. Принцип неопределенности Гейзенберга. Уравнение Шредингера.
2. Квантовые числа электрона в атоме. Принцип Паули.
3. Электронные конфигурации атомов. Правило Гунда. Электронные уровни и подуровни. Порядок заполнения орбиталей электронами. Правило Клечковского.
4. Изменения по периодам и группам таблицы Менделеева значений эффективного и орбитального радиусов атомов элементов; энергии сродства атома Э к электрону, энергии ионизации и электроотрицательности.
5. Кривая потенциальной энергии для молекул. Характеристика ХС, ее энергия и длина. Полярность. Дипольный момент. Поляризуемость связи. Поляризующее действие элементов в соединениях.
6. Типы химических связей. Направленность и насыщаемость связи. Как сказывается тип ХС на свойствах веществ?
7. Водородная связь. Межмолекулярные связи (ММС) или силы Ван-дер-Ваальса (ориентационные, индукционные и дисперсионные взаимодействия). Свойства соединений, имеющих тот или иной тип связи.
8. Рассмотрение свойств ХС с позиции метода ВС. Валентность элементов. Типы перекрывания атомных орбиталей. Кратность связей.
9. Типы гибридизации АО и форма молекул. Одинаковую ли форму имеют частицы: СО2, NO2, H2O, H2S? Дипольный момент молекулы.
10. Влияние несвязывающей электронной пары центрального атома и кратности ХС на валентные углы. Почему валентные углы в H2O и NH3 меньше, чем в СН4? Валентные углы в молекуле 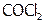 равны 111,30 и 124,30. Определите, какое значение относится к углу
равны 111,30 и 124,30. Определите, какое значение относится к углу 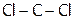 , а какое – к углу
, а какое – к углу  . Почему?
. Почему?
11. Метод МО. Схема образования МО из 1s АО. Связывающие и разрыхляющие орбитали. Электронное строение молекул и молекулярных ионов элементов первого периода таблицы Д.И.Менделеева. Порядок связи.
12. Электронное строение гомоядерных молекул и молекулярных ионов элементов второго периода таблицы Д.И. Менделеева.
13. Гетероядерные двухатомные частицы элементов второго периода таблицы Д.И.Менделеева. Особенности их связывающих и разрыхляющих МО. Чем отличаются диаграммы гетероядерных и гомоядерных частиц? Одноцентровые и несвязывающие МО. «Молекула» LiH.
14. Описание с позиции ММО молекул: СО2, BeF2, BeН2.
15. Выберите изоэлектронные частицы из ряда: С2,  ,
, 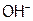 ,
, 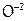 , CO,
, CO, 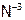 ,
, 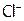 ,
,  ,
,  , K, BN, C, N2. В чем суть метода изоэлектронных серий?
, K, BN, C, N2. В чем суть метода изоэлектронных серий?
16. Определение формы молекул: SF4, ClF3, BrF5, XeF4 и др., имеющих орбитальнодефицитные связи, а также описание орбитальноизбыточных ХС (например, в B2H6) с использованием теории гипервалентной связи.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 917; Нарушение авторских прав?; Мы поможем в написании вашей работы!