
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролитическая диссоциация
|
|
|
|
Вопросы к семинару
1. Какие процессы происходят при растворении соли в воде? Что называется растворимостью вещества?
2. Как зависит растворимость соединений от температуры? Почему?
3. Классификация солей по величине растворимости. ПР.
4. Влияет ли на ПР температура, состав раствора, степень дисперсности, структура или количество осадка, находящегося в равновесии с раствором? а на растворимость осадка? Солевой эффект.
5. Какие расчеты можно проводить, исходя из ПР?
6. Составить каждому студенту задачу по теме «ПР» и привести ее решение.
Степень диссоциации электролитов (обозначается 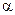 ), т.е. распад их при растворении на ионы, определяется отношением:
), т.е. распад их при растворении на ионы, определяется отношением:
 .
.
И если электролит диссоциирован в растворе лишь частично ( ), то он относится к слабым. А поскольку электропроводность растворов обеспечивают свободные гидратированные ионы, то, очевидно, высокую проводимость имеют достаточно концентрированные растворы именно тех веществ, которые полностью диссоциированы на ионы, т.е. относятся к сильным электролитам. Для них
), то он относится к слабым. А поскольку электропроводность растворов обеспечивают свободные гидратированные ионы, то, очевидно, высокую проводимость имеют достаточно концентрированные растворы именно тех веществ, которые полностью диссоциированы на ионы, т.е. относятся к сильным электролитам. Для них 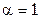 – это имеет место, например, в 0,1М НСl. Однако значение проводимости этого раствора указывает на то, что лишь
– это имеет место, например, в 0,1М НСl. Однако значение проводимости этого раствора указывает на то, что лишь  ионов реально обеспечивают проводимость, а 20% находятся в неактивном состоянии, что объясняется ассоциацией частиц, в частности, образованием ионных пар:
ионов реально обеспечивают проводимость, а 20% находятся в неактивном состоянии, что объясняется ассоциацией частиц, в частности, образованием ионных пар:  [8].
[8].
При повышении концентрации раствора (до определенного[25] предела) доля ассоциатов будет расти и, значит, активность растворенного вещества ( ) падать, ибо увеличивается ионная сила (
) падать, ибо увеличивается ионная сила (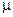 ) раствора.
) раствора.
Значение 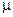 рассчитывается по формуле:
рассчитывается по формуле:  , где
, где 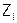 – заряды ионов. Например, в случае 0,1М НCl и 0,1н H2SO4:
– заряды ионов. Например, в случае 0,1М НCl и 0,1н H2SO4:
 ,
, 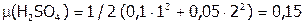 .
.
По значениям m, используя справочную таблицу (приложение 2), находим значения коэффициентов активности (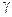 ) для
) для 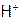 : 0,76 и 0,73 соответственно. И, следовательно, активности
: 0,76 и 0,73 соответственно. И, следовательно, активности 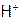 в данных растворах:
в данных растворах:  и
и  моль/л. Из их сравнения видно, что серная кислота должна хуже проводить ток, чем хлороводородная.
моль/л. Из их сравнения видно, что серная кислота должна хуже проводить ток, чем хлороводородная.
Рассмотрим как влияет повышение ионной силы раствора на диссоциацию сильных кислот. Если к 1 л 0,1н 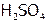 (его рН= –lg[H+]= –lg
(его рН= –lg[H+]= –lg  =1,14) добавить 0,1 моль NaCl, то хотя при этом
=1,14) добавить 0,1 моль NaCl, то хотя при этом 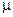 увеличивается с 0,15 до 0,25 (
увеличивается с 0,15 до 0,25 ( (0,1 . 12 + 0,05 . 22 + 0,1 . 12 + 0,1 . 12)), а поэтому
(0,1 . 12 + 0,05 . 22 + 0,1 . 12 + 0,1 . 12)), а поэтому 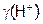 снижается (до 0,67), но рН изменится мало (до 1,18), т.е. раствор останется почти таким же кислым, как и исходный.
снижается (до 0,67), но рН изменится мало (до 1,18), т.е. раствор останется почти таким же кислым, как и исходный.
Практически тот же результат получается и при добавлении соли, содержащей анион, одноименный с кислотным остатком, например,  .
.
Однако если добавить к серной кислоте такое же количество соли, образованной слабой кислотой (например, KCN), то ионы водорода свяжутся в молекулы слабой кислоты HCN. И тогда именно диссоциация последней станет определять 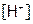 в растворе; рассчитаем эту концентрацию. Состав раствора слабых электролитов строго характеризуется термодинамической константой равновесия диссоциации [8]. Мы же для расчета
в растворе; рассчитаем эту концентрацию. Состав раствора слабых электролитов строго характеризуется термодинамической константой равновесия диссоциации [8]. Мы же для расчета 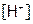 возьмем концентрационную константу. Так, для диссоциации синильной кислоты:
возьмем концентрационную константу. Так, для диссоциации синильной кислоты:  , она будет иметь вид:
, она будет иметь вид:
 .
.
Обозначим 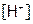 за Х моль/л, тогда и
за Х моль/л, тогда и  моль/л, т.к. при диссоциации HCN эти ионы образуются в одинаковых количествах (если пренебречь ионами
моль/л, т.к. при диссоциации HCN эти ионы образуются в одинаковых количествах (если пренебречь ионами 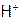 , образующимися при диссоциации воды). Очевидно, концентрация молекул кислоты, например, в 0,1М растворе, будет равна:
, образующимися при диссоциации воды). Очевидно, концентрация молекул кислоты, например, в 0,1М растворе, будет равна: 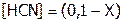 моль/л.
моль/л.
Подставляя эти обозначения в выражение 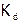 (значение
(значение 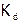 берем из справочника), получим:
берем из справочника), получим:  [26], откуда:
[26], откуда:
 (моль/л).
(моль/л).
Эта концентрация водорода почти в 10 тыс. раз меньше, чем в случае сильных кислот той же концентрации, т.е. значение рН [27] ( ) гораздо ближе к рН нейтрального раствора (равного 7).
) гораздо ближе к рН нейтрального раствора (равного 7).
При добавлении соли, содержащей анион одноименный с анионом слабой кислоты, равновесие диссоциации этой кислоты сместится влево (по принципу Ле Шателье), и значение pH раствора еще более приблизится к 7 [28].
Можно так же значительно уменьшить щелочность раствора, добавляя к нему соль слабого основания, например, NH4Cl. На подобной нейтрализующей способности солей слабых кислот (или слабых оснований) основано и действие буферных растворов. Так, если взять смесь слабой кислоты и ее соли, например, 1л раствора 0,1М по СН3СООН и 0,1М по СН3СООNa, имеющий  (пример расчета рН аналогичной смеси приведен ниже) и добавить 0,01 моль НСl, то вся эта кислота расходуется на протекание реакции:
(пример расчета рН аналогичной смеси приведен ниже) и добавить 0,01 моль НСl, то вся эта кислота расходуется на протекание реакции:
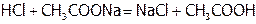 или:
или:  .
.
В итоге раствор станет 0,11М по СН3СООН и 0,09М по СН3СООNa, и рН снизится незначительно: с 4,75 до 4.66. А добавление того же количества НCl к 1 л воды резко уменьшает рН: с 7 до 2 (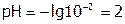 ).
).
C другой стороны, при добавлении к данной исходной смеси 0,01 моль NaOH протекает реакция нейтрализации:
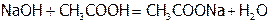 или:
или:  .
.
Как следствие, раствор станет 0,09М по СН3СООН и 0,11М по СН3СООNa и рН тоже изменится незначительно (с 4,75 до 4,83). А при добавлении 0,01 моль NaOH к 1 л воды рН резко увеличивается: с 7 до 12 ( ).
).
Итак, буферными называются растворы, которые практически не изменяют значения рН при добавлении сравнительно небольших количеств сильных кислот или щелочей, а также при разбавлении. (Докажите последнее расчетом самостоятельно.)
Буферные растворы применяют, когда важно поддержать практически постоянное значение рН при добавлении сильной кислоты или щелочи. Пределы этих добавлений определяются так называемой буферной емкостью смеси, то есть количеством кислоты или щелочи, добавление которого изменяет значение рН одного литра буферного раствора на 1.
ЛАБОРАТОРНАЯ РАБОТА
«Электролитическая диссоциация»
ПРИМЕЧАНИЕ. При оформлении отчета привести уравнения диссоциации использованных электролитов и проведенных реакций (в молекулярном и ионном виде).
1. Электропроводность растворов электролитов. В стакан на 200 мл налить 20 мл 1М уксусной кислоты и опустить в него (на определенную глубину) угольные электроды, последовательно соединенные с электролампой, выключателем и источником тока. Включить ток и отметить накал лампы. Долить в стакан воды примерно до 100 мл (глубину погружения электродов сделать прежней!!!). Изменяется ли при этом накал лампы? Почему? Выключить ток.
В другой стакан на 200 мл налить 50 мл 1М аммиака и, промыв электроды, опустить их в данный раствор. Включить ток и отметить накал лампы. Добавить уксусную кислоту из первого стакана и перемешать. Изменился ли накал лампы? Выключить ток. Дать объяснение эксперименту.
2. Сравнение реакционной способности кислот. В две пробирки отобрать равные объемы (примерно по 0,5 см3) порошка оснóвного карбоната меди(II) и прилить по 1 мл 1н растворов кислот: в одну пробирку – хлороводородной, а в другую – серной. Сравнить скорости выделения газа и окрашивания растворов. Затем в первую пробирку добавить 1 мл 2М ацетата натрия, а во вторую – 1 мл 2М хлорида натрия. Сравнить снова скорость процессов в обеих пробирках и объяснить результаты.
3. Изменение рН при разбавлении сильной кислоты. С помощью иономера измерить рН 0,1М HСl, затем рН этого раствора, разведенного в 100 раз (разводить последовательно: вначале в 10 раз, потом, отобрав порцию полученного раствора, еще в 10 раз). Сравнить измеренные значения рН и теоретически рассчитанные. Как меняется кажущаяся степень диссоциации при разбавлении раствора?
4. Определение константы диссоциации слабого электролита. Измерить (как можно точнее!) рН 0,01М аммиака, рассчитать константу диссоциации гидрата аммиака и сравнить с табличным ее значением. Какова ошибка определения?
5. Влияние одноименного иона на степень диссоциации. В пробирку налить 1 мл 0,1М аммиака, измерить его рН с помощью универсальной индикаторной бумаги (УИБ) [29] и добавить 2 капли фенолфталеина. Что наблюдается и почему? Затем вносить в пробирку по 2–3 кристаллика хлорида аммония (каждый раз интенсивно перемешивать до их полного растворения), пока раствор ни обесцветится. Снова измерить рН индикаторной бумагой. Объяснить результаты.
6. Свойства буферного раствора.
а) Разбавление. С помощью УИБ определить рН ацетатного буфера, затем, взяв 1 мл этого раствора, развести его в 100 раз. Каково значение рН полученного раствора? Объяснить результаты.
б) Добавление кислоты и щелочи. В две пробирки налить по 2 мл аммиачного буфера, измерить его рН, используя УИБ, затем в одну пробирку добавить каплю 1М HCl, в другую – каплю 1М NaOH, перемешать и определить рН полученных растворов. Аналогичный опыт проделать с чистой водой и сделать выводы.
в) Определение буферной емкости. В стаканчик на 100 мл налить 20 мл 0,1М ацетатного буфера и измерить его кислотность с помощью иономера. Затем добавлять (удобнее из бюретки) по 0,2 мл 1М HCl при перемешивании, определяя рН раствора после каждого добавления. Опыт закончить, когда рН изменится более чем на единицу по сравнению с исходным значением. На основании полученных результатов рассчитать буферную емкость исследованного раствора.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 1118; Нарушение авторских прав?; Мы поможем в написании вашей работы!