
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Редокс-процессы
|
|
|
|
Реакции, идущие с изменением ст.ок. элементов, называются окислительно-восстановительными (ОВР) или редокс - процессами [8]. Причем вещество, отдающее электроны, является восстановителем, а принимающее их – окислителем.
Окислители и восстановители. Редокс-свойства соединений определяются положением их элементов в таблице Менделеева. Так, типичные окислители:
а) простые вещества, атомы которых имеют высокую ЭО (F2, O2, Cl2 и др.);
б) сложные соединения, содержащие катионы металлов в сравнительно высоких неустойчивых ст.ок. (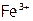 ,
, 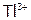 и др.);
и др.);
в) вещества, в которые входят сложные анионы с центральным атомом в высокой неустойчивой ст.ок. (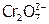 ,
, 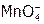 и т.п.);
и т.п.);
г) пероксидные соединения: пероксид водорода ( ), мононадсерная (
), мононадсерная (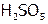 ) и двунадсерная (
) и двунадсерная (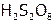 ) кислоты, их соли и т.п.
) кислоты, их соли и т.п.
К типичным восстановителям относятся:
а) простые вещества, атомы которых характеризуются низкой ЭО (щелочные металлы (ЩМ), щелочноземельные металлы (ЩЗМ), алюминий, цинк).
б) сложные соединения, содержащие элементы в низких неустойчивых ст.ок. (в качестве катионов:  ,
,  и т.п. или анионов:
и т.п. или анионов:  ,
,  и др.); а также в неустойчивой промежуточной ст.ок. (
и др.); а также в неустойчивой промежуточной ст.ок. (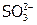 ,
, 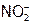 ). При повышенных температурах проявляют восстановительные свойства также Н2, СО, уголь (кокс).
). При повышенных температурах проявляют восстановительные свойства также Н2, СО, уголь (кокс).
Однако деление веществ на окислители и восстановители относительно, поскольку в зависимости от условий большинство их проявляют и окислительные, и восстановительные свойства. Чаще это наблюдается в случае соединений, содержащих элементы в промежуточной ст.ок. Так, типичный окислитель Н2О2 восстанавливает перманганат калия в кислой среде:
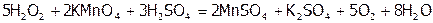 [38],
[38],
а типичный восстановитель 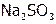 окисляет сульфиды ЩМ:
окисляет сульфиды ЩМ:
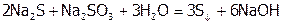 .
.
Кроме того, восстановители, включающие атомы в низшей ст.ок., могут быть окислителями за счет другого элемента. Например, типичный восстановитель аммиак может (в жидком состоянии) окислять щелочные металлы благодаря наличию Н+:
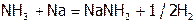 .
.
Аналогично, типичные окислители могут за счет другого элемента проявлять восстановительные свойства. Так, при термическом разложении KMnO4 атомы кислорода О2- (восстановитель) окисляются марганцем (VII), переходя в О2.
Иногда атомы двух (или более) элементов в соединении одновременно выступают в роли восстановителя (или окислителя), например:
 .
.
Здесь восстановители: 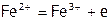 и
и 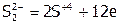 ,
,
а окислитель: 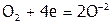 .
.
ОВП. Мерой редокс-способности веществ служат окислительно-восстановительные потенциалы (ОВП) [8]. Их стандартные значения (обозначаются 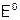 ) приведены в справочниках. Чем больше алгебраическая величина
) приведены в справочниках. Чем больше алгебраическая величина 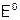 , тем сильнее окислительные свойства соединений, а чем она меньше, тем выше восстановительные свойства. В соответствии со значением
, тем сильнее окислительные свойства соединений, а чем она меньше, тем выше восстановительные свойства. В соответствии со значением 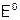 построен ряд напряжений.
построен ряд напряжений.
Типы редокс-реакций. ОВР подразделяются на межмолекулярные и внутримолекулярные. К внутримолекулярным процессам (в случае веществ немолекулярной структуры они называются внутрифазными) относятся те, при осуществлении которых происходит изменение ст.ок. разных атомов в одном и том же соединении. Чаще это реакции термического разложения:
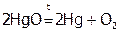 .
.
Большинство ОВР относятся к межмолекулярным; тем более что внутримолекулярные реакции идут обычно по сложному механизму, включающему и межмолекулярные процессы. Существует разновидность ОВР, в которых окислитель или восстановитель выполняет дополнительные функции, например, создает среду:
 ,
,
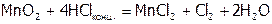 .
.
К особому виду относятся реакции дисмутации. Они возможны в тех случаях, когда переход атома элемента в состояние с большей ст.ок. требует меньше энергии, чем ее выделяется при образовании меньшей ст.ок. этого же Э, поэтому идет одновременно повышение и понижение ст.ок. одного и того же элемента:
 ,
,  .
.
Процессы обратныедисмутации – это реакции конмутации, когда в роли и окислителя, и восстановителя выступает один и тот же Э, но в разных ст.ок., а продуктом является вещество, содержащее этот элемент в промежуточной ст.ок.:
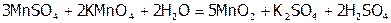 .
.
Составление уравнений ОВР. Составление уравнения дает возможность определить количественные соотношения реагирующих веществ, а в ряде случаев указывает также на условия проведения процесса. В настоящее время для составления уравнений редокс-реакций используют или метод электронного баланса (ЭБ), или электронно-ионного баланса (ЭИБ), т.е. метод полуреакций.
Метод ЭБ более универсален, т.к. позволяет устанавливать стехиометрические отношения соединений в ОВР для любых гомо- и гетерогенных систем. Однако при подборе коэффициентов уравнений реакций, протекающих в водных растворах, предпочтительнее метод полуреакций. Во-первых, ЭИБ позволяет опустить операции определения ст.ок. элементов[39]. Во-вторых, в процессе его использования сразу получается сокращенное ионное уравнение ОВР. В третьих, по уравнению полуреакций удается установить влияние среды на ОВП вещества.
Кроме того, при составлении ЭИБ оперируют ионами, реально существующими в водном растворе, в отличие от метода электронного баланса, который имеет дело с гипотетическими частицами типа  ,
,  и т.п.
и т.п.
При нахождении стехиометрических коэффициентов уравнения редокс-процесса методом ЭИБ нужно выполнить следующие операции:
1. Определить окислитель и восстановитель среди реагирующих веществ (по значениям 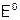 ), а также продукты их взаимодействия (по полуреакциям окисления, приведенным в справочнике). Например, для реакции пероксида водорода с перманганатом калия в сернокислой среде нашли, что:
), а также продукты их взаимодействия (по полуреакциям окисления, приведенным в справочнике). Например, для реакции пероксида водорода с перманганатом калия в сернокислой среде нашли, что:
 В, а
В, а  В,
В,
т.е. более сильным окислителем является пероксид водорода. Но 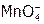 -ионы не могут выступать в данных условиях в роли восстановителя, в то время как пероксид, содержащий кислород в промежуточной степени окисления (–1), может окисляться до
-ионы не могут выступать в данных условиях в роли восстановителя, в то время как пероксид, содержащий кислород в промежуточной степени окисления (–1), может окисляться до 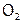 и при этом его потенциал:
и при этом его потенциал: 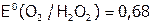 В.
В.
Итак, окислитель –  , восстановитель –
, восстановитель –  , а продукты ОВР: MnSO4 и
, а продукты ОВР: MnSO4 и 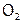 .
.
2. Получить уравнения полуреакций (в сокращенном ионном виде), исходя из схем окисления:  и восстановления:
и восстановления: 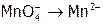 .[40]
.[40]
Для этого схемы уравнивают: а) по числу атомов элемента, меняющего ст.ок. (в нашем примере это не требуется).
б) по кислороду, добавляя его в составе молекул воды:
 ,
,  ;
;
в) по водороду, добавляя его в виде ионов водорода:
 ,
,  ;
;
г) по суммарному заряду ионов, отнимая (или добавляя) нужное число электронов: 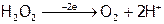 ,
,  .
.
3. Уравнять полуреакции между собой по числу отданных и принятых электронов и суммировать отдельно левые и правые части:

Сокращая, получим ионное уравнение данной ОВР:
 .
.
Если исходная среда является не кислой, а нейтральной или щелочной, то к обеим частям полученного уравнения нужно добавить ОН--ионы в количестве, эквивалентном числу Н+, и, заменив (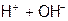 ) на
) на  , сократить молекулы воды.
, сократить молекулы воды.
4. Перейти к молекулярному виду уравнения, добавляя катионы и анионы, остающиеся в результате реакции без изменения, т.е. ионы-«наблюдатели» (в нашем примере: 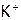 и
и  ):
):  .
.
ЛАБОРАТОРНАЯ РАБОТА «ОВР»
Примечание: Все уравнения ОВР в данной работе получить методом ЭИБ с приведением схем уравнивания полуреакций.
1. Окислительная активность пероксидных соединений. Отобрать в пробирку 4 капли раствора соли хрома(III), 3 капли 1М серной кислоты и 2 капли нитрата серебра (в качестве катализатора), нагреть пробирку пламенем спиртовки, внести в раствор 3 кристаллика пероксодисульфата калия ( ) и продолжить нагревание до изменения окраски. Объяснить результат. Написать графическую формулу пероксодисульфат-иона. За счет он проявляет редокс-свойства?
) и продолжить нагревание до изменения окраски. Объяснить результат. Написать графическую формулу пероксодисульфат-иона. За счет он проявляет редокс-свойства?
2. Соединения серы в редокс-процессах.
а) Как восстановитель. К 3 каплям раствора дихромата калия добавить 4 капли 1М серной кислоты, 2 лопаточки сульфида натрия и тщательно перемешать. Отметить и объяснить внешний эффект.
б) Конмутация. Повторить опыт (а), заменив 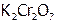 на
на  .
.
в) Дисмутация. Отобрать в две пробирки по 3–4 кристаллика сульфита натрия. Одну пробирку оставить в качестве контрольной, а вторую закрепить в штативе и нагревать в течение 5–6 мин. Дать ей остыть. Затем в обе пробирки добавить по 6 капель воды и после полного растворения солей по 3 капли сульфата меди(II). Объяснить наблюдение. Как изменилась ст.ок. серы(IV) при нагревании?
3. Олово(II) в ОВР.
а) Как восстановитель. Отобрать в пробирку по 3 капли растворов хлорида железа(III) и гексациано(III)-феррата калия (зачем?). Отметить окраску (присутствуют ли ионы железа(II) в растворе хлорида железа(III) в аналитически определяемых количествах?) и добавить 3 капли хлорида олова(II). Отметить наблюдаемый эффект и объяснить его.
б) Как окислитель. Внести в пробирку 6 капель хлорида олова(II) и кусочек цинка. Изменяется ли внешний вид цинка? Объяснить наблюдаемые явления. Окислительная или восстановительная активность олова(II) выше?
4. Влияние среды на протекание редокс-реакций. В три пробирки отобрать по 6 капель перманганата калия, затем в одну добавить 8 капель 1М серной кислоты, во вторую – столько же воды, в третью – 1 гранулу сухой щелочи, затем во все три пробирки всыпать по 2 лопаточки нитрита калия (или сульфита натрия) и перемешать до полного растворения соли. Отметить и объяснить внешние эффекты. Происходит ли выделение бурого газа в первой пробирке? Чем это объяснить?
Рассчитать мольную массу эквивалентов перманганата калия в каждом случае. В какой среде меньше расходуется KMnO4: в кислой, нейтральной или щелочной? Почему? Всегда ли среда влияет на величину ОВП?
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 1668; Нарушение авторских прав?; Мы поможем в написании вашей работы!