
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типовые задачи
|
|
|
|
Свойства растворов высокомолекулярных веществ (ВМВ)
Дополните высказывание
11. СТРУКТУРНОЙ ЕДИНИЦЕЙ КОЛЛОИДНОГО РАСТВОРА ЯВЛЯЕТСЯ _________.
12. МЕТОД ПОЛУЧЕНИЯ КОЛЛОИДНЫХ ЧАСТИЦ ДИСПЕРСНОЙ ФАЗЫ ПУТЕМ ДРОБЛЕНИЯ КРУПНЫХ ЧАСТИЦ НА БОЛЕЕ МЕЛКИЕ НАЗЫВАЕТСЯ __________________
13. ОСЕДАНИЕ КОЛЛОИДНЫХ ЧАСТИЦ ПОД ДЕ5ЙСТВИЕМ СИЛ РАЗНОЙ ПРИРОДЫ НАЗЫВАЕТСЯ ___________________
14. АГРЕГАТ И ПОТЕНЦИАЛ-ОПРЕДЕЛЯЮЩИЕ ИОНЫ СОСТАВЛЯЮТ __________.
Контрольные задания
15. Напишите формулы мицелл и укажите их строение:
1) AgBr в KBr
2) BaCO3 в (NH4)2CO3
3) CaCO3 в CaC12
4) Cu2[Fe(CN)6] в K4[Fe(CN)6]
16. Составьте формулу мицеллы золя AgС1, полученной при взаимодействии равных объемов 0,01М раствора AgNO3 и 0,05 М раствора NaC1. Укажите, какой ион будет оказывать наибольшее коагулирующее действие в данном золе.
17. Составьте формулу частицы дисперсной фазы золя, полученного в результате реакции обмена при сливании 14 см3 0,007 моль/дм3 раствора ZnSO4 и 6 см3 0,004 моль/дм3 раствора NaOH.
Литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов / Ю. А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – 5-е изд., стер. – М.: Высш.шк., 2005. – С. 423 – 446; 491 – 518.
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – М.: Высш. шк., 2008. – С. 207-214.
Растворы ВМВ
Высокомолекулярные вещества (полимеры) – это вещества с молекулярной массой от десяти тысяч до нескольких миллионов единиц.
Размеры молекул ВМВ в вытянутом состоянии могут достигать 1000 нм. Температура кипения ВМВ значительно выше температуры разложения, поэтому они существуют, как правило, только в жидком или твердом состоянии.
По происхождению ВМВ делятся на:
1. Природные ВМВ или биополимеры (белки, нуклеиновые кислоты, полисахариды, а также биополимеры смешанного типа – гликопротеины, нуклеопротеины и др.) являются структурной основой всех живых организмов.
2.Синтетические (каучук, полиэтилен, синтетические смолы) и искусственные ВМВ получаются в результате химического синтеза. Методы синтеза ВМВ основаны на реакциях полимеризации, поликонденсации и сополимеризации.
3. Искусственные ВМВ изготавливают на основе природных ВМВ с заранее заданными свойствами.
Степенью полимеризации n называется число повторяющихся звеньев в макромолекуле ВМВ. Любой синтетический полимер состоит из макромолекул разной степени полимеризации и характеризуется полидисперсностью.
По строению полимерной цепи ВМВ бывают
Ø линейными,
Ø разветвленными,
Ø пространственными.
Например,
целлюлоза (растительный полисахарид) – имеет линейную структуру,
гликоген (животный полисахарид) – имеет разветвленную структуру,
фенопласты – имеет пространственную сетчатую структуру.
В животном организме присутствуют в основном плохорастворимые полимеры разветвленной и пространственной структур.
По способности к электролитической диссоциации ВМВ делятся на
Ø неэлектролиты
Ø полиэлектролиты.
Полиэлектролиты подразделяются на поликислоты, полиоснования и полиамфолиты.
Макромолекулы могут принимать различную форму в результате конформационных изменений: линейную, клубка, глобул.
Конформации и различные состояния объясняются стремлением к самопроизвольному уменьшению энергии Гиббса (∆G< 0), которое происходит при условии T·∆S > ∆H.
Таким образом, конформация представляет собой пространственную форму макромолекул, соответствующую максимуму энтропии.
Конформационными переходами можно объяснить многие процессы, происходящие в организме, например, регуляцию активности ферментов.
Гибкость как свойство молекулы обусловливает эластичность как свойство материала (например, эластичность волос, кожи и т.п.).
Макромолекулы ВМВ имеют уровни структурной организации. Для молекул белков известно 4 уровня структурной организации.
Первичная структура – это последовательность аминокислотных остатков в полипептидной цепи.
Вторичная структура – пространственная структура в виде α-спирали (фибриноген крови), либо β-структура складчатого листа (кератин волос).
Третичная структура – расположение вторичной структуры в пространстве. При этом образуются субъединицы белка или микроструктуры.
Четвертичная структура – объединение субъединиц в макроструктуры (гемоглобин крови).
Нативная, природно заданная структура белка способна нарушаться под действием различных факторов (резкие колебания температуры, рН, присутствия солей тяжелых металлов и др.). Денатурация белка – это нарушение первоначальных свойств белка, вызванное изменением пространственной структуры его макромолекулы и сопровождающееся изменением физико-химических и биологических свойств белка.
Белки в процессе денатурации:
• теряют гидрофильные свойства,
• нарушаются форма и размеры макромолекул,
• увеличивается вязкость растворов,
• уменьшается растворимость белков и степень набухания,
• денатурированные белки быстрее перевариваются ферментами желудочно-кишечного тракта по сравнению с нативными.
Растворы ВМВ являются лиофильными коллоидными системами. Для них характерны свойства как общие с растворами низкомолекулярных веществ и коллоидными системами, так и специфические.
Растворы ВМВ с истинными растворами низкомолекулярных веществ имеют ряд общих свойств:
1) образуются самопроизвольно;
2) являются термодинамически устойчивыми и не требуют присутствия стабилизаторов;
3) в растворах ВМВ взвешенными частицами являются не мицеллы, а макромолекулы, способные диссоциировать на ионы;
4) в растворах ВМВ отсутствует четко выраженная поверхность раздела фаз, их можно разбавлять и концентрировать.
К специфическим свойствам растворов ВМВ относят:
1) высокую степень набухания полимера;
2) высокая вязкость раствора;
3) низкую нестабильную величину осмотического давления раствора.
Набухание ВМВ
ВМВ набухают и растворяются в низкомолекулярных жидкостях. Так как подвижность молекул растворителя намного больше подвижности макромолекул, то первой стадией взаимодействия является набухание – проникновение молекул растворителя в структуру ВМВ со значительным увеличением его массы и объема, но с сохранением формы; образуется гель. Если низкомолекулярная жидкость ограниченно растворима в ВМВ, то набухание будет ограниченным, оно не заканчивается образованием текучей системы. Растянутая сетка макромолекул, стремясь сократиться, препятствует увеличению содержания растворителя.
При неограниченной растворимости низкомолекулярной жидкости в полимере его пачки после набухания продолжают раздвигаться и макромолекулы постепенно диффундируют в растворитель, образуя раствор. Такое набухание называют неограниченным.
В синтетических полярных полимерах и белках набухание начинается с сольватации полярных групп. При этом выделяется наибольшее количество теплоты. Установлено, что, например, на 1 г крахмала выделяется 6,6 кал, на 1 г желатина – 5,7 кал. При образовании сольватных слоев поглощается около 20–40% растворителя от массы сухого полимера. Следующая стадия набухания – поглощение десятикратного объема растворителя – объясняется осмотическими явлениями. С термодинамической точки зрения процессы набухания ВМС и растворения низкомолекулярных веществ весьма сходны между собой.
На набухание влияют также такие физико-химические факторы, как температура, рН среды, электролиты и др.
Повышение температуры способствует более быстрому набуханию, так как усиливается движение частиц, что способствует разрыхлению внутренних структур. Для каждого высокомолекулярного вещества и растворителя должна существовать своя критическая температура, выше которой происходит их безграничное смешение.
Изменение рН среды в более кислую или щелочную сторону от изоэлектрической точки коллоида увеличивает степень набухания. Это объясняется появлением положительного и отрицательного заряда у коллоидных частиц и, следовательно, повышением степени гидратации.
Влияние анионов на процесс набухания оценивают с помощью лиотропного ряда Гоффмейстера:
SO42- < C6H5O7 3- < C4H4O6 2- < C2H4O2 - < Cl - < NO3 - < Br - < I - < CNS –
цитрат тартрат ацетат
Как видно из данного ряда, соли серной и уксусной кислот замедляют набухание, а роданид-анионы способствуют набуханию. Из катионов: K+ и Na+ способствуют, а ионы Ca2+ - препятствуют набуханию.
Набухание оценивается по степени набухания массы жидкости, поглощенной 1 г сухого полимера. Степень набухания определяют весовым и объемным методом. Весовым методом определяют массу сухого и набухшего полимера и по разности находят массу поглощенной жидкости. Объемным методом измеряют изменение объема тела при поглощении им жидкости, или объема жидкости, в котором происходит набухание. Степень набухания α вычисляют по уравнению:
 или
или 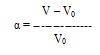 , где
, где
m0, V0 – масса и объем полимера до набухания
m, V – масса и объем полимера после набухания
Набухание имеет большое значение в процессах жизнедеятельности растительных и животных организмов. Прорастанию семян всегда предшествует предварительное набухание. Растительные и животные ткани связывают большое количество воды (соединительная ткань) и содержат коллоиды не только в виде растворов, но и в студнеобразном состоянии (протоплазма клеток, хрусталик глаза и др.).
Чередование в зависимости от рН среды и концентрации электролитов процессов набухания и обезвоживание соединительной ткани влияет на распределение воды, а также ионов между соединительной тканью и клетками.
Набухание и обезвоживание коллоидов наблюдается при самых различных процессах: регенерации тканей, воспалении, образовании отеков, при проникновении кислых жидкостей в ткани, при ожоге кожи крапивой, при укусе насекомых и т.п. Во всех указанных случаях набухание зависит, главным образом, от изменения в тканях рН среды.
Вязкость растворов ВМВ
Растворы высокомолекулярных соединений отличаются высокой вязкостью (или внутренним трением), обусловленной силами сцепления между молекулами жидкости.
Количественно вязкость характеризуют коэффициентом вязкости η (этта), Па ∙ с.
Отношение вязкости раствора к вязкости чистого растворителя обозначают относительной вязкостью:
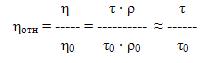
где, η, ρ, τ – вязкость, плотность, время истечения раствора;
η0, ρ0, τ0 – вязкость, плотность, время истечения чистого растворителя.
! В сильно разбавленных растворах ρ ≈ 1г/см3, т.е. плотностью можно пренебречь.
Увеличение вязкости, связанное с изменением концентрации при растворении полимера, принято характеризовать удельной вязкостью:

η – вязкость раствора;
η0 – вязкость чистого растворителя.
Для линейной (вытянутой) формы макромолекул удельную вязкость рассчитывают по уравнению Штаудингера:
ηуд. = К· М(X) · C(X)
М (Х) – относительная молекулярная масса полимера [а. е. м.];
C (X) – весовая концентрация полимера [г · м-3];
К – константа, характеризующая особенности гомологического ряда полимера.
Величина ηуд/С получила название приведенной вязкости:
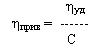
Предел ηуд/С при С→0 отражает гидродинамическое сопротивление движению молекул полимера и именуется характеристической вязкостью [η].
При вискозиметрическом методе определения молекулярного веса полимера вначале устанавливают η0, η; затем рассчитывают ηуд и ηприв для растворов различной концентрации и строят график зависимости приведенной вязкости от концентрации. Эта зависимость представляет прямую, которая при продолжении до пересечения с осью ординат отсекает отрезок, равный [η].
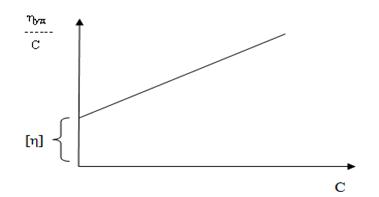
Рис. Зависимость ηприв от С ВМВ для раствора высокомолекулярного соединения.
Уравнение Марка-Хаувинка устанавливает связь между характеристической вязкостью и молярной массой ВМВ.
[η] = К ∙ Мα, где
М – средняя молекулярная масса ВМВ;
К – коэффициент постоянный для растворов ВМВ одного гомологического ряда в данном растворителе;
α – коэффициент, характеризующий гибкость цепей макромолекул в растворе и их форму в зависимости от конформации.
Осмотическое давление растворов ВМВ
В растворах ВМВ осмотическое давление имеет ряд особенностей. Это связано с тем, что макромолекула ВМВ может рассматриваться как совокупность молекул меньшего размера.
Это учитывает уравнение Галлера:
πосм = (СВМВ/МВМВ) ∙ RТ+βС2ВМВ, где
СВМВ – весовая концентрация полимера, г/м3;
β – коэффициент, учитывающий форму, гибкость, размеры макромолекулы.
Если концентрация раствора невелика, то βС2ВМВ → 0, тогда уравнение Галлера переходит в уравнение Вант-Гоффа.
Измеряя осмотическое давление растворов различных концентраций и строя график зависимости πосм/ СВМВ от СВМВ, находят значение молярной массы полимера и коэффициента β.
Контрольные вопросы
1. ВМВ. Биополимеры. Белки. Биологическая роль белков и их суточная потребность.
2. Физико-химические характеристики макромолекул белков: молекулярная масса, размер, структура, гибкость.
3. Специфические свойства растворов ВМВ:
а) Набухание. Степень набухания, факторы, влияющие на набухание. Ограниченное и неограниченное набухание.
б) Вязкость. Удельная, приведенная и характеристическая вязкости.
в) Осмотическое давление.
4. Растворы белков. Агрегативная устойчивость белков. Понятие о высаливании, денатурации, коацервации.
5. Влияние рН среды на состав и свойства растворов белков. Изоэлектрическая точка белков и ее значение.
Задача 1. Определите молярную массу полиметилметакрилата по следующим данным вискозиметрического метода:
| Концентрация раствора, кг/м3 | 1,0 | 1,2 | 1,4 | 1,6 | 1,8 | 2,0 |
| Приведённая вязкость раствора ВМС в бензоле | 0,408 | 0,416 | 0,430 | 0,434 | 0,442 | 0,452 |
Константы: К = 4,7·10– 8; α = 0,77.
Решение:
1. По приведенным данным строим график зависимости ηприв — Сраствора. Методом экстраполяции определяем значение характеристической вязкости ([η]).
В нашем случае [η] ≈ 0,4035.
2. Используя уравнение Марка-Хаувинка, находим молярную массу полимера:
[η] = К ∙ Мα
lg [η] = lg K + α∙lg M
α∙lg M = lg [η] – lg K
lg [η] – lg K lg 0,4035 – lg 4,7·10– 8
lg M = ----------------- = ------------------------------- = 9,005
α 0,77
M = 10 9,005 = 1011579454 (кг/моль)
Ответ: М = 1011579454 (кг/моль)
Тестовые задания
Выберите правильный вариант ответа
01. НАБУХАНИЕ – ЭТО ПРОЦЕСС ПРОНИКНОВЕНИЯ
1) ВМВ в полимер
2) полимера в ВМВ
3) ВМВ в НМС
4) НМС в ВМВ
02. ПРОЦЕСС НАБУХАНИЯ ВМВ ЯВЛЯЕТСЯ
1) самопроизвольным, ΔG > 0
2) несамопроизвольным, ΔG > 0
3) самопроизвольным, ΔG < 0
4) несамопроизвольным, ΔG < 0
03. НАБУХАНИЕ БЕЛКОВ ПРОИСХОДИТ ПРИ: А) ВОЗНИКНОВЕНИИ ОТЕКОВ;
Б) СОКРАЩЕНИИ МЫШЦ; В) ПЕРЕВАРИВАНИИ ПИЩИ; Г) ТЕРМИЧЕСКОЙ КУЛИНАРНОЙ ОБРАБОТКЕ ПИЩИ
1) а, б, в
2) а, в, г
3) а, б, в, г
4) а, в
04. УВЕЛИЧЕНИЕ ВЯЗКОСТИ КРОВИ ПРОИСХОДИТ ПРИ: А) АТЕРОСКЛЕРОЗЕ;
Б) ВЕНОЗНЫХ ТРОМБОЗАХ; В) ПОВЫШЕНИИ КОНЦЕНТРАЦИИ БЕЛКА В ПЛАЗМЕ; Г) ОТЕКАХ; Д) СНИЖЕНИИ КОНЦЕНТРАЦИИ БЕЛКА В ПЛАЗМЕ КРОВИ
1) а, б, в
2) а, б, в, г
3) а, б, г
4) а, в, г
05. ПОЛИСТИРОЛ ЯВЛЯЕТСЯ
1) неорганическим полимером
2) олигомером
3) синтетическим полимером
4) природным полимером
06. КРАХМАЛ И ЦЕЛЛЮЛОЗА ЯВЛЯЮТСЯ
1) неорганическим полимером
2) олигомером
3) синтетическим полимером
4) природным полимером
07. В ИЗОЭЛЕКТРИЧЕСКОМ СОСТОЯНИИ ПОЛИЭЛЕКТРОЛИТЫ
1) обладают наибольшей устойчивостью
2) имеют наибольшую степень набухания
3) обладают наименьшей устойчивостью
4) обладают электрофоретической подвижностью
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 2087; Нарушение авторских прав?; Мы поможем в написании вашей работы!