
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика зачетной работы и инструкция по ее выполнению
|
|
|
|
Лечебное дело; 060103-педиатрия
Лица, нарушающие требования настоящей инструкции, привлекаются к административной ответственности.
Требования безопасности по окончании работы
5.1. Все пролитое и разбитое или просыпанное на столах, мебели или на полу немедленно убрать.
5.2. После завершения эксперимента Ваше рабочее место должно быть приведено в порядок.
5.3. Грязную посуду следует вымыть сразу же после окончания работы.
3. Кодификатор зачетной работы дисциплины «Химия»
для студентов I курса специальностей
Кодификатор отражает содержание дисциплины, перечень контролируемых
учебных элементов, количество заданий по каждому разделу дисциплины,
включенных в билет зачета
| № | Элементы содержания дисциплины | Перечень контролируемых учебных элементов | кол-во заданий в билете | |
| I. Элементы химической термодинамики | ||||
| 1. | Основные понятия химической термодинамики | Знать: понятия
| ||
| 2. | Первое начало термодинамики. Термохимия. Закон Гесса. | Знать: понятия
| ||
Уметь: рассчитывать
| ||||
| 3. | Второе начало термодинамики | Знать: понятия
| ||
Уметь: рассчитывать
| ||||
| 4. | Химическое равновесие | Знать: понятия
| ||
| II. Учение о растворах | ||||
| 5. | Растворы. Способы выражения концентрации растворов | Знать: понятия и
Уметь: рассчитывать
| ||
| 6. | Растворы ВМС. Биополимеры. Полиэлектролиты | Знать: понятия
| ||
| 7. | Комплексные соединения | Знать: понятия
| ||
Уметь:
| ||||
| III. Электрохимия | ||||
| 8. | Основные понятия электрохимии. Электроды. Гальванические цепи. | Знать: понятия
| ||
| 9. | Окислительно-восстановительные электроды | Знать: понятия
| ||
| IV. Поверхностные явления и дисперсное состояние вещества | ||||
| 10. | Поверхностные явления | Знать: понятия
| ||
| 11. | Дисперсные системы. Коллоидные системы | Знать: понятия
| ||
На выполнение зачетной работы отводится 1,5 часа (90 минут). Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 5 заданий. К каждому заданию дается 4 варианта ответов, из которых один правильный. Номер выбранного ответа проставляется в матрице ответов в соответствующей клетке (1-5)
Часть 2 включает 3 расчетные задачи, решение которых следует оформить в экзаменационной работе, записать ответ и выбрать из четырех предложенных после каждой задачи. Номер выбранного ответа следует внести в соответствующую клетку (6-8) матрицы ответов.
Часть 3 содержит два теоретических вопроса, которые требуют полного развернутого письменного ответа, оформленного в зачетной работе.
Постарайтесь выполнять задания в том порядке, в котором они даны в билете. При выполнении работы Вы можете пользоваться периодической системой химических элементов Д.И. Менделеева, таблицей ряда активности металлов, таблицей растворимости солей, кислот и оснований, калькулятором.
Демонстрационный вариант билета зачетной работы
Перед началом работы начертите таблицу
| № зад. | ||||||||
| Индекс отв. |
Часть 1
1.Энтропия системы служит мерой...
1. устойчивости системы к распаду
2. тепловой энергии системы
3. неупорядоченности и бесструктурности системы
4. температуры системы
2. Для смещения равновесия в системе
CO(г) + Cl2(г) ↔ COCl2(г), Δ H 0 < 0, в сторону образования продуктов необходимо
1. понизить температуру и давление
2. повысить температуру и давление
3. понизить температуру и повысить давление
4. повысить температуру и понизить давление
3. По правилу --------: на твердой кристаллической поверхности адсорбента адсорбируются те ионы, которые входят в состав кристаллической решетки адсорбента
1. Фаянса
2. изоморфизма
3. Гендерсона-Гассельбаха
4. Менделеева-Клайперона
4. Комплексное соединение Ca [ Pt+4 (NO2)4 (Cl)2 ]имеет название
1. дихлоротетранитроплатинат (II) кальция
2. дихлоротетранитроплатинат (IV) кальция
3. дихлоротетранитратоплатинат (II) кальция
4. дихлоротетранитратоплатинат (IV) кальция
5. Щавелевой кислотой в кислой среде 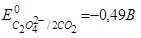 восстанавливается ион:
восстанавливается ион:
| 1) Сг3+ → Сг2+; | Е° = –0,51 В; |
| 2) А13+ → А1; | Е° = –1,66 В; |
| 3) Mn2+ → Mn; | E° = –1,19B; |
| 4) MnO4– → Mn2+; | Е° = +1,51 В. |
Часть 2
6. Рассчитайте молярную концентрацию эквивалента раствора пероксида водорода, содержащего 1,5 г Н2О2 в 250 см3 раствора. Какой объём раствора калия перманганата с концентрацией С (1/5 КMnO4) = 0,2 моль·дм-3 израсходуется на титрование 25 см3 этого раствора?
1. 4,8 моль·дм-3 ; 52 см3 2. 0,35 моль·дм-3; 43,8 см3
3. 0,56 моль·дм-3 ; 43 см3 4. 2,5 моль·дм-3; 10 см3
7. Вычислите ∆Н° реакции С6Н12О6 → 2С2Н5ОН + 2СО2,
если: ∆Н° сгорания (С6Н12О6) = -2815,8 кДж·моль-1
∆Н° сгорания (С2Н5ОН) = -1366,9 кДж·моль-1
∆Н° сгорания (СО2) = 0 кДж·моль-1
1. -82 кДж·моль-1 2.+82 кДж·моль-1
3. -164 кДж·моль-1 4.+164 кДж·моль-1
8. Как изменится потенциал марганцевого электрода, если активную концентрацию ионов Mn2+ в жидкой фазе электрода при 298 К повысить от 0,01 моль·дм-3 до 0,05 моль·дм-3?
Е0Mn2+/Mn = -1,18 В.
1. уменьшится на 0,042В
2. уменьшится на 0,021В
3. увеличиться на0,021В
4. увеличиться на 0,042В
Часть 3
9. Высокомолекулярные вещества (ВМВ). Классификация. Структура, форма макромолекул и типы связей между ними. Гибкость макромолекул.
10. Мицелла, её строение. Электрокинетический потенциал как фактор, определяющий поведение мицеллы. Для золя иодида серебра, полученного по реакции
AgNO3(изб.) + KI → AgI + KNO3
а) указать потенциалопределяющие ионы
б) указать противоионы
в) написать формулу мицеллы
г) привести пример ионов, вызывающих коагуляцию золя
Матрица ответов к демонстрационному варианту билета
| № зад. | ||||||||
| Индекс ответа |
Выполнение заданий билета оценивается следующей суммой баллов
| Часть | № задания | балл оценки | Итого |
| I | 1 – 5 | по 1 баллу | 5 баллов |
| II | 6 баллов 6 баллов 5 баллов | 17 баллов | |
| III | 4 балла 4 балла | 8 баллов | |
| Итого максимально: 30 баллов (100%) |
Таблица перевода набранной суммы баллов
в пятибалльную систему оценки зачетной работы
| Оценка | Итого (сумма баллов) |
| «5» (отлично) | 25 – 30 (83-100%) |
| «4» (хорошо) | 19 – 24 (63-82%) |
| «3» (удовлетворительно) | 12– 18 (40-62%) |
| «2» (неудовлетворительно) | менее 12 (менее 40%) |
Заключение
Важнейшими факторами реализации современных требований к химическому образованию медиков и качественному овладению предметом общей химии являются обновление его содержания и современная организация процесса его усвоения. Наиболее рациональный путь достижения этих требований - не расширение объема и углубления содержания, а более обоснованный отбор учебного материала, улучшение его организации и методики преподавания в рамках сокращающихся часов, не удлинение сроков обучения, а изменение методических подходов к его изучению, активизация и интенсификация учебного процесса, познавательной деятельности и самостоятельной работы студентов.
Курс общей химии в медицинском вузе выполняет целый ряд задач:
- фундаментальная общехимическая подготовка студентов, формирование у них химической картины природы в общем контексте естествознания и медицины в частности;
- развитие у студентов логики и интеллектуальных умений для дальнейшего освоения фундаментальных теоретических и клинических специальных дисциплин, в частности умение прогнозировать основные физические и химические свойства веществ, а также возможность протекания биохимических процессов;
- осознание студентами значимости химических знаний и умений во всей их последующей профессиональной медицинской деятельности.
Учебное пособие дисциплины «Химия» позволяет студентам решать данные задачи и активизирует их самостоятельную работу при подготовке к занятиям.
Содержание всех компонентов структуры пособия позволит студентам – первокурсникам закрепить пройденный программный материал и будет способствовать его более глубокому и прочному усвоению, что очень важно для будущего врача, поскольку химия входит в число наук, составляющих фундамент современной медицины.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 568; Нарушение авторских прав?; Мы поможем в написании вашей работы!