
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коергизм при действии ксенобиотиков на разные участки рецепторной молекулы
|
|
|
|
Конкуренция за рецепторы одного типа
Принципиально возможные механизмы конкуренции двух токсикантов на уровне рецептора представлены на рисунке 3.

Рисунок 3. Механизмы конкуренции двух токсикантов на уровне рецептора
В качестве рецептора для токсикантов (А, В) могут выступать активный (Е) и аллостерический (R) центры энзима, участвующего в превращении субстрата (S) и собственно рецепторы для эндогенных биорегуляторов (нейромедиаторов, гормонов). Биологическая активность энзима проявляется скоростью превращения субстрата, рецепторного протеина - инициацией физиологической реакции (выделение секрета железой, сокращение мышечного волокна, изменение потенциала биологической мембраны и т.д.)
При изучении серии веществ по их способности конкурировать за рецептор можно прийти к определенным типам коергизма (таблица 9).
Таблица 9. Типы коергизма токсикантов при действии на рецептор
| Действие на биосистему только А | Действие на биосистему как А, так и В | Изменение эффекта | Вид коергизма |
| ++ ++ ++ | ++ + | - -- | конкурентный синергизм конкурентный дуализм конкурентный антагонизм |
Низкомолекулярные вещества способны атаковать биологически активные протеины различными способами. Образуемые при этом связи токсиканта и протеина являются как специфическими (с активным центром энзима, аллостерическим центром энзима, рецепторной структурой и т.д.), так и неспецифическим (с сульфгидрильными, гидроксильными, аминогруппами белков и т.д.). Рецепторный ареал биологически активного протеина часто представляет собой относительно небольшой участок связывания субстрата и окружающий его периферический отдел. Решить вопрос о специфичности и неспецифичности (конкурентности и неконкурентности) действия токсиканта на рецепторную молекулу, как правило, чрезвычайно сложно. Лишь для некоторых энзимов и рецепторных протеинов изучены молекулярные механизмы их взаимодействия с отдельными токсикантами. Так, установлены закономерности взаимодействия ФОС с активным центром холинэстеразы и влияние так называемых реактиваторов холинэстеразы (оксимов) на этот процесс (см. раздел "Противоядия").
Показано, что морфин и N-аллилморфин очевидно реагируют с различными участками одной и той же молекулы опиатного рецептора. Антагонизм между веществами, по-видимому, основан на том, что рецептор к морфину при взаимодействии с одним из этих соединений принимает конформацию, затрудняющую взаимодействие с другим.
N-этилмалеинимид, р-хлормеркуробензоат, цистеин, ионы ртути и мышьяка и другие вещества способны связываться с SH-группами белковых молекул, изменяя их конформацию. Таким образом, функциональные свойства молекул изменяются вследствие модификации структуры рецептора.
В холинэргических рецепторах пункт связывания ацетилхолина соседствует с -S-S- связью белковой молекулы, восстановление или окисление которой оказывает влияние на способность рецептора взаимодействовать с АХ. Восстановить дисульфидную связь можно с помощью 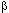 -меркаптоэтанола, окислить - гипосульфитом натрия. В опытах in vitro оба вещества существенно изменяют реакцию биопрепаратов на ацетилхолин, а также токсиканты, обладающие холиномиметической и холинолитической активностью.
-меркаптоэтанола, окислить - гипосульфитом натрия. В опытах in vitro оба вещества существенно изменяют реакцию биопрепаратов на ацетилхолин, а также токсиканты, обладающие холиномиметической и холинолитической активностью.
Различные функциональные группы белков легко взаимодействуют с алкилирующими агентами, например с ипритами, формальдегидом, промежуточными продуктами метаболизма хлорированных углеводородов (дихлорэтан и т.д.), арсенидами, солями ртути и т.д. По большей части это ковалентные, и, следовательно, практически необратимые связи. Если рецепторная структура инактивирована за счет ковалентного связывания с токсикантом, то восстановление её активности возможно только путем синтеза de novo.
В ходе токсикологических экспериментов при изучении коергизма между неконкурентными токсикантами, как правило, выявляется их способность одновременно изменять как сродство биомишени к эндогенным субстратам и ксенобиотикам-агонистам, так и активность соответствующей биомолекулы.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 565; Нарушение авторских прав?; Мы поможем в написании вашей работы!