
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Авогадро
|
|
|
|
Закон сформульований італійським вченим А. Авогадро (закон Авогадро), звучить так: в однакових об’ємах будь-яких газів за однакових зовнішніх умов (температура і тиск) міститься однакове число молекул.
Цей закон має можливі наслідки. Оскільки 1 моль будь-якого газу містить NA молекул, то 1 моль будь-якого газу за сталих умов завжди займає один і той самий об’єм. За нормальних умов, тобто при температурі 273,15 К (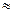 273К) або 00С і тиску 101325 Па (
273К) або 00С і тиску 101325 Па (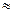 101,3 кПа), об’єм 1 моля будь-якого газу дорівнює 22,4 л. Стала
101,3 кПа), об’єм 1 моля будь-якого газу дорівнює 22,4 л. Стала 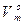 =22,4 л/моль називається молекулярним об’ємом газу за нормальних умов. За будь-яких умов молекулярний об’єм газу дорівнює відношенню об’єму газу за даних умов до кількості речовини цього газу:
=22,4 л/моль називається молекулярним об’ємом газу за нормальних умов. За будь-яких умов молекулярний об’єм газу дорівнює відношенню об’єму газу за даних умов до кількості речовини цього газу:
 , (3.1)
, (3.1)
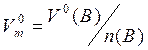 , (3.2)
, (3.2)
де Vм і V(B) – відповідно молярний об’єм і об’єм газу В за будь-яких умов;
(B) – об’єм газу В за нормальних умов;
(B) – кількість речовин газу В.
Слід зазначити, що закон Авогадро справедливий для ідеальних газів. Для реальних газів спостерігаються відхилення від закону: молярний об’єм деяких газів за нормальних умов дещо менший за 22,4 л\моль. Наприклад, для хлороводню він становить 22,2 л/моль, для хлору – 22,0 л\моль. У цьому конспекті значення молярного об’єму газів за нормальних умов вважається сталою величиною, можливі відхилення не враховуються.
Із закону Авогадро випливає: якщо об’єми двох газів (газ 1 і газ 2) V(1) і V(2) за сталих умов дорівнюють один одному, то однакове й число молекул кожного газу, тобто N(1) = N(2), або за формулою 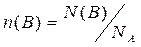 n(1)NA =n(2)NA n(1) = n(2). Використавши формулу
n(1)NA =n(2)NA n(1) = n(2). Використавши формулу  , отримаємо
, отримаємо
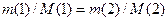 або
або 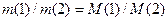 .
.
Позначивши 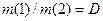 , отримаємо:
, отримаємо:
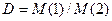 , (3.3)
, (3.3)
де D –відносна густина першого газу (1) за другим (2); 
M(1) і M(2) – молярні маси газів.
Найчастіше використовують значення відносних густин газів за воднем Dн або за повітрям Dп:
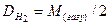 , (3.4)
, (3.4)
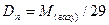 , (3.5)
, (3.5)
де 29 г/моль – середня молярна маса повітря.
Відносні густини газів за воднем і повітрям визначають експериментально. Знаючи густину газу, можна обчислити його молярну масу.
Ідеальний газ – ідеальна модель газу, яка припускає, що взаємодії між молекулами газу немає.
Розглянемо приклади задач, для розв’язування яких використовуються наслідки закону Авогадро
Приклад 1. Який об’єм за нормальних умов займе кисень масою 8 г?
Розв’язання. Молярна маса кисню дорівнює М(О2) = 32г/моль. Використовуючи формулу  , визначаємо кількість речовини О2:
, визначаємо кількість речовини О2:
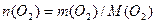 ; п (О2) = 8/32 моль = 0,25 моль
; п (О2) = 8/32 моль = 0,25 моль
За формулою (1.2) знаходимо об’єм газу:
 ;
; 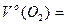 22,4·0,25 л = 5,6 л.
22,4·0,25 л = 5,6 л.
Приклад 2. Визначте молярну масу газоподібної речовини, якщо її густина за повітрям дорівнює 1,517.
Розв’язок. Молярну масу газу розраховуємо, використовуючи формулу (3.5):
М(газу) = Дп·29; М(газу) = 1,517·29 г/моль = 44,0 г/моль.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 479; Нарушение авторских прав?; Мы поможем в написании вашей работы!