
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характер перекривання орбіталей , і міцність зв'язку
|
|
|
|
У зовнішньому енергетичному рівні, як це витікає з будови атома, можуть бути неспарені і спарені електрони. Якщо електрони в орбіталі неспарені, то орбіталь називається одноелектронною або ненасиченою, а якщо в орбіталі спарені електрони, то орбіталь називається насиченою.
У хімічному зв'язку можуть брати участь як неспарені, так і спарені електрони, або ненасичені і насичені орбіталі. Якщо в утворенні зв'язку бере участь насичена орбіталь, то електрони повинні розпаритись. Це може трапитися лише при збудженні атома. Атом може збуджуватись при поглинанні будь-якої енергії. Процес збудження можна передати за допомогою рівняння збудження. Розглянути це можливо на прикладі збудження атома берилію: 4 9Ве0 + hν =4 9Ве*
| S | S | |||||||||||
| ↑↓ | P | ↑↓ | P | |||||||||
| ↑↓ | + | hν | = | ↑ | ↑ |
Із електронно-графічної формули берилію видно, що один S-електрон зовнішнього енергетичного рівня перейшов на Р-орбіталь того ж рівня.
Це вищий за енергією підрівень. Форми орбіталей S-електрона і Р-електрона, звичайно, неоднакові. Дослідження хімічного зв'язку у сполуках, наприклад, хлориді берилію, показують, що він рівноцінний. Це веде до думки, що завдяки утворенню хімічного зв’язку між берилієм і хлором, енергія орбіталей у берилія вирівнюється. Це вирівнювання енергії орбіталей перед утворенням хімічного зв'язку називається гібридизацією. Із однієї S-орбіталі та однієї Р-орбіталі утворюються дві нові орбіталі як за енергією, так і за формою. Ця орбіталь називається гібридною і має таку форму
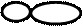 |
: S + P =2q.
Такий вид гібридизації називається sр-гібридізацією.
Якщо збуджений атом берилію вступає в реакцію з двома атомами хлору, утворюється хлорид берилію:
Ве* + С12 =- ВеС12
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 583; Нарушение авторских прав?; Мы поможем в написании вашей работы!