
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічний еквівалент
|
|
|
|
Еквівалентом речовини називається деяка умовна частина цієї речовини, яка в даній реакції сполучається з одним атомом чи іншим або заміщує його. Наприклад, у реакції:
2НСl + Са(ОН)2 = СаСl2 + 2Н2О
двом атомам водню еквівалентна умовна частина в НСl відповідає одна частина Са(ОН)2. Отже, одному атому водню еквівалентна умовна частина,що дорівнює ½ Са(ОН)2.Це й буде еквівалентом гідроксиду кальцію Са(ОН)2. Число ½ носить назву фактора еквівалентності, який позначається символом fекв.(В) (В-речовина). У наведеному прикладі fекв.Са(ОН)2= ½.
Фактор еквівалентності деяких речовин можна обчислити за простими формулами. Для кислоти фактор еквівалентності дорівнює оберненій величині її основності (число іонів ОН- у молекулі основи, які в реакції заміщуються на кислотні залишки):
 (3.6)
(3.6)
 (3.7)
(3.7)
Фактор еквівалентності однієї й тієї самої речовини у різних реакціях може бути різним. Це видно з такого прикладу. У реакції нейтралізації фосфорної кислоти, що відбувається за рівнянням
Н3РО4 + 3КОН = К3РО4 + 3Н2О,
Три іони Н + заміщуються на К+, тобто (Н+) = 3. Отже, згідно з формулою (3.6), фактор еквівалентності фосфорної кислоти дорівнюватиме 
Якщо Н3РО4 + 2КОН = К2НРО4 + 2Н2О, то (Н+) = 2,
тобто f ек в. (Н3РО4) =1/2.
Молярна маса еквівалента речовини В (в г/моль) – добуток фактора еквівалентності на молярну масу цієї речовини:
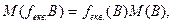 (3.8)
(3.8)
Молярну масу еквівалента можна називати також еквівалентною масою.
Кількість речовини еквівалента (в моль) – це відношення маси речовини до молярної маси її еквівалента:
 (3.9)
(3.9)
Кількісні співвідношення між еквівалентами речовини, що беруть участь у хімічній реакції, задаються законом еквівалентів.
Згідно з цим законом для реакції
А + В = С + Д
Повинно виконуватись співвідношення

тобто речовини взаємодіють і утворюються в кількостях, які дорівнюють кількостям речовин еквівалентів.
Отже, для речовин А і В, що взаємодіють, можна записати:
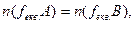
Використовуючи формулу (3.9), отримуємо:
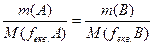 ,
,
або
 (3.10)
(3.10)
Співвідношення (1.10) є наслідком закону еквівалентів. Нижче наведено приклад використання закону еквіваленті у хімічних розрахунках.
Приклад.Сірчана кислота масою 4,9 г прореагувала з гідроксидом калію масою 2,8 г. Визначте молярну масу еквівалента сірчаної кислоти і напишіть рівняння реакції.
Розв’язок. Для гідроксиду калію КОН завжди (ОН-) = 1, отже fекв.(КОН) = 1.
За формулою (3.8) обчислюємо молярну масу еквівалента КОН:
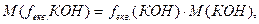
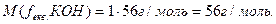
Використавши формулу (3.10), знаходимо молярну масу еквівалента сірчаної кислоти:
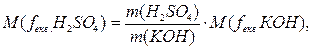
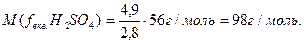
Фактор еквівалентності сірчаної кислоти дорівнює:


Отже, у даній реакції лише один атом водню в молекулі H2SO4 заміщується на метал. Реакція відбувається за рівнянням
H2SO4 + KOH = KHSO4 + H2O.
Тема 2. Будова атому та хімічний зв’язок
Квантово-механічна модель атома. Будова атомного ядра. Ізотопи. Радіоактивність. Будова електронних оболонок атома. Квантові числа. Атомні орбіталі. Принцип Паулі. Правило Гунда. Правило Клечковського. Електронні й електронно-структурні формули.
Хімічний зв’язок. Сутність хімічного зв’язку. Основні типи й характеристики хімічного зв’язку. Ковалентний, іонний. Енергетичне співвідношення різних типів зв’язку. Полярний зв'язок, електричний момент диполя. Ступінь окислення. Метод валентних зв’язків. Метод молекулярних орбіталей. Зонні діаграми речовин – діелектриків, напівпровідників, провідників. Гібридизація орбіталей. Будова й властивості найпростіших молекул.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 2106; Нарушение авторских прав?; Мы поможем в написании вашей работы!