
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Періодичний закон Д. І. Менделєєва
|
|
|
|
Вчені за часів Д. І. Менделєєва, намагаючись класифікувати відомі хімічні елементи, поділили їх на родини. Було відомо 6 груп подібних за властивостями елементів: лужні метали, лужноземельні метали, галогени, група Оксигену, група Нітрогену і група Карбону (знайди їх за періодичною системою). Але згрупувати всі відомі на той час 63 хімічні елементи не вдавалося. Знання про них були уривчасті. У той час учені думали, що природні групи елементів, особливо протилежні за властивостями, ніяк між собою не зв'язані. І хоча вони звертали увагу на зв'язок властивостей речовин з відносною атомною масою елемента, що утворює цю речовину, їм не вдалося об'єднати всі елементи в єдину систему. Спираючись на праці своїх попередників, це завдання розв'язав великий російський учений Д. І. Менделєєв.
На відміну від своїх попередників Д. І. Менделєєв був глибоко переконаний, що між усіма хімічними елементами, як подібними за властивостями, так і відмінними, повинен існувати природний загальний зв'язок, який об'єднував би всі елементи в єдину систему.
За основу систематизації хімічних елементів Д. І. Менделєєв (так само, як і раніше Лотар Мейєр) обраввідносну атомну масу, вважаючи її головною характеристикою елемента, оскільки вона не змінюється під час утворення елементом простих і складних речовин. Водночас Д. І. Менделєєв не розглядав масу як єдину характеристику елемента. Він надавав великого значення ще й його хімічним властивостям.
Згрупувавши більшість відомих тоді хімічних елементів у кілька горизонтальних рядів так, щоб вертикальні стовпчики включали елементи, подібні за хімічними властивостями, Д. І. Менделєєв у 1869 р. розробив періодичну систему у формі таблиці — прообраз сучасної періодичної системи хімічних елементів. А далі добудовував і доповнював цю первісну таблицю, доки не включив до неї всі відомі на той час 63 елементи. Один із останніх варіантів періодичної системи, створеної Д. І. Менделєєвим, за формою мало чим відрізняється від відомої нам сучасної періодичної системи.
Вивчаючи зміну властивостей елементів, розміщених у ряд у порядку зростання їх відносних атомних мас, Д. І. Менделєєв виявив повторення однакових ознак у хімічних елементів і назвав цю закономірність періодичністю. Виявлену закономірність він сформулював у вигляді періодичного закону, суть якого опублікував у 1869 p.:
властивості елементів, а тому і властивості утворених ними простих і складних речовинперебувають у періодичній залежності від величини атомних мас елементів.
ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА
ЗаслугаД. І. Менделєєва полягає в тім, що виявлену залежність він зрозумів як об'єктивну закономірність природи, чого не змогли зробити його попередники. Завдяки відкриттю періодичного закону було виявлено, що всі елементи взаємозв'язані, підпорядковані єдиному закону і становлять єдину систему, яка справедливо була названа на честь ученого «періодичною системою хімічних елементів Д. І. Менделєєва».
Одним із способів зображення періодичної системи елементів є графічне (табличне) вираження періодичного закону хімічних елементів, так званий короткий варіант побудови періодичної системи.
Для побудови системи Д. І. Менделєєву довелося припустити інші значення відносних атомних мас майже у 20 елементів. Так, більшість учених вважали відносну атомну масу Берилію такою, що дорівнює 13,5 (знайди Be за періодичною системою). Однак за сукупністю властивостей Д. І. Менделєєв розмістив Берилій між Літієм і Бором, зробивши висновки, що відносна атомна маса Берилію має дорівнювати 9. Пізніше експериментальні дослідження довели справедливість припущення Д. І. Менделєєва. Це було перше практичне застосування періодичної системи.
Будуючи періодичну систему, Д. І. Менделєєв залишив багато клітинок вільними. Серед 63 відомих тоді елементів ще не було таких, які за величиною відносних атомних мас і сукупністю властивостей могли б зайняти ці місця. Тим самим він довів, що повинні існувати елементи, котрі були ще невідомі. Він дійшов висновку, що їх властивості мають бути проміжними між властивостями сусідніх елементів, що розміщуються ліворуч і праворуч у тому самому ряду, й сусідніх елементів, що стоять вище і нижче. Це такі елементи, як Галій Ga, Германій Ge і Скандій Sc. Д. І. Менделєєв назвав їх,
відповідно, екаалюміній, екасиліцій та екабор1.
1 Ека — слово, запозичене Д. І. Менделєєвим зі стародавньої писемної мови Індії — санскриту. «Ека» означає «один». Пропонуючи заздалегідну назву елемента № 31 екаалюміній, Д. І. Менделєєв виходив із того, що він «іде за алюмінієм», перший його аналог.
Тріумфом періодичного закону було відкриття в 1875 р. французьким ученим Лекок де Буабодраном нового елемента, названого Галієм (на честь стародавньої назви Франції). Властивості Галію, визначені експериментально, повністю збігалися із властивостями екаалюмінію, передбаченими Д. І. Менделєєвим.
Впродовж наступних 15 років передбачення Д. І. Менделєєва блискуче підтвердились: були відкриті прості речовини, утворені передбаченими елементами.
Проте наприкінці XIX ст. були відкриті інертні гази (Не, Ne, Аr, Кr, Хе). їх молекули одноатомні. На відміну від усіх інших неметалів, вони не утворюють сполук із Гідрогеном і металами. Несподіване відкриття інертних газів стало важким випробуванням для періодичної системи, оскільки для них не було вільних клітинок. Д. І. Менделєєв утворив для них окрему групу (нульову), розмістивши інертні гази між галогенами і лужними металами. У результаті періоди набули свого логічного завершення. Все це зумовило загальне визнання періодичного закону і періодичної системи елементів.
Яка ж структура короткої форми періодичної системи? Основними структурними одиницями є періоди і групи.
Період — це горизонтальний ряд хімічних елементів, розміщених у порядку зростання їх відносних атомних мас, що починається лужним металом і закінчується інертним газом.
Усього періодів сім. Із них перші три — малі періоди, бо кожний складається з одного ряду хімічних елементів. Починаючи з четвертого, ідуть великі періоди (кожний складається з двох рядів). Усього рядів десять. Кожний період містить певне число хімічних елементів:
1- й період (малий) — 2 елементи;
2- й період (малий) — 8 елементів;
3- й період (малий) — 8 елементів;
4- й період (великий) — 18 елементів;
5- й період (великий) — 18 елементів;
6- й період (великий) — 32 елементи;
7- й період (великий) — досі ще не завершений, містить поки що 24 елементи.
Група — це вертикальний стовпчик, в якому один під одним розміщені подібні за властивостями хімічні елементи.
Усього груп вісім. Кожна з них поділяється на дві підгрупи: А — головну, до складу якої входять елементи малих періодів (типові) і Б — побічну, яка складається тільки з елементів великих періодів, вони є неповними аналогами типових елементів і навіть можуть дуже відрізнятися від них за властивостями. Так, сьома група складається з головної підгрупи — Флуор, Хлор (типові елементи) та їх аналоги — Бром, Йод, Астат, і побічної, до складу якої входять елементи тільки великих періодів — Манган,
Технецій, Реній. Елементи головної підгрупи — активні неметали, а елементи побічної — метали.

Мал. 1. Періодична система хімічних елементів.
'' Основні закономірності періодичної системи:
1. У малих періодах із зростанням відносних атомних мас елементів спостерігається поступове послаблення металічних і наростання неметалічних властивостей.
2. У великих періодах спостерігається деяка періодичність у зміні властивостей всередині самих періодів. У парних рядах великих періодів металічні властивості елементів послаблюються повільно, в результаті всі елементи парних рядів — метали. У непарних рядах великих періодів властивості елементів змінюються так само, як і в елементів малих періодів: металічні властивості послаблюються, а неметалічні — посилюються.
3. Особливу подібність властивостей виявляють елементи, розміщені всередині великих періодів, наприкінці кожного парного ряду. Це так звані тріади: Ферум — Кобальт — Нікол, що утворюють родину Феруму, і дві інші: Рутеній — Родій — Паладій та Осмій — Іридій — Платина, що утворюють родину платинових металів (платиноїдів). Виділяють ще родину лантаноїдів (14 елементів шостого періоду) і родину актиноїдів (14 елементів сьомого періоду). Елементи кожної з цих родин за властивостями дуже подібні між собою.
4. У групах у міру зростання відносних атомних мас елементів їх металічні властивості посилюються, а неметалічні — послаблюються (в елементів побічних підгруп бувають винятки).
5. У періодичній системі посилення металічних властивостей елементів у групах зверху вниз і послаблення їх у періодах зліва направо зумовлюють появу діагональної подібності. Так, Берилій більше подібний до Алюмінію, ніж до Магнію, а Бор — до Силіцію, ніж до Алюмінію (див. періодичну систему).
6. У періодах валентність елементів зростає: у малих періодах — від 1 до 8, у великих періодах — двічі, що й дало Д. І. Менделєєву підставу розмістити елементи великих періодів у два ряди.
7. У групах валентність елементів, як правило, відповідає номеру групи. Деякі елементи побічних підгруп можуть виявляти й іншу валентність. Так, Купрум — елемент І групи побічної підгрупи — утворює оксиди Сu2O і CuO та гідроксиди CuOH та Сu(ОН)2, де валентність Купруму дорівнює 1 і 2.
8. Елементи перших трьох груп — метали, вони летких сполук з Гідрогеном не утворюють. Це характерно для елементів головних підгруп IV—VII груп. При цьому валентність елемента дорівнює різниці між числом 8 і номером групи, в якій розмішується елемент.
Тема 5. Розчини
Розчини — це гомогенні, термодинамічно стійкі системи, які складаються з розчинннка, розчиненої речовини і продуктів їх взаємодії, які назнваються гідратами, якщо розчинником виступає вода. Гомогенні — це означає однорідні: розчини, які не маютъ механічних домішок., прозорі на вигляд. Термодикамічна стійкість оцінюється нагріванням розчину: під час нагріванні не спостерегаються будь-які зміни в системі. Якщо розчин закупорити і залишити на довгий час, то з часом ніяких змін не відбувається.
Поняття «розчинник» і «розчинена речовина» умовні Все залежнть від співвідношень речовин у системі.. Якщо розглядати спиртовий розчин, то спирт і вода міняються ролями. Коли маємо 40 % розчин спирта у воді, то міркування такі: обидві сполуки спирт і вода в стандартних умовах — рідини. Та речовина в розчині, якої більше эа масою виступає розчинником, а якої менше — розчиненою речовиною. У 40 % розчині води більше ніж спирту, тому вода виступає розчиннєком, а спирт розчиненою речовиною. Якщо взяти, наприклад, 60 % розчин спирту у воді, то тут більше буде спирту, тому він буде розчинником, а розчиненою речовиною — вода. До речі, ці дві хімічні сполуки називають асоціативними сполуками, тобто такими, які взаємно розчиняються одна з одній в необмежених кількостях.
Другий приклад, повітря. Чисте повітря це також дисперсна система або газоподібний розчин. Азоту у повітрі більше, ніж кисню; тому азот можна розглядати як розчинник а кисень і інертні гази — розчиненими сполуками.Є і тверді розчини, наприклад, сплав золота з міддю — сплав, який іде на виготовлення дорогоцінних речей. Наприклад, 583-я проба золота означає, що на кожні 1000 г сплаву припадає 583 г золота, а решта мідь. Золота в сплаві білыпе; тому воно виступає розчинником.
Розчинення відбувається відповідно до закону дифузії. Швидкість переходу розчинюванної речовини в розчинник збільшується при підвищенні ступеня дисперсності, температури (для твердих і рідких речовин), тиску (для газів). Процес розчинення є не тільки механічним процесом, він супроводжується також зміною об’єму і теплового ефекту. Це свідчить про те, що при розчиненні відбувається хімічна взаємодія між розчинником і розчинюваною речовиною. На основі експериментальних даних Д.І. Мендєлєєв розробив гідратну теорію, згідно з якою процес розчинення є сукупністю фізичних і хімічних процесів. При розчиненні руйнуються хімічні зв’язки в речовині яка розчиняється (перший процес), що пов’язано з витратами енергії (ΔН1>0).
Наступний (другий) процес, пов’язаний із взаємодією між частинками розчиненої речовини й розчинником (сольватація) утворюються нові хімічні зв’язки що, супроводжується виділенням енергії (ΔН2<0).
Якщо при розчиненні речовин теплота поглинається(ендотермічний процес), то тепловий ефект першого процесу більший, ніж тепловий ефект другого, а при екзотермічному процесі розчинення – навпаки.
Зв’язок між молекулами води та іонами буває настільки міцним,що вони викриталізовуються разом, утворюючи кристалогідрати. Тому, солі у вигляді кристалогідратів мають забарвлення, зумовлене наявністю іонів, що зв'’зані з молекулами води.
CuSO4 5H2O FeSO4 7H2O Na2SO4 10H2O
Мідний купорос Залізний купорос Глауберова сіль
/голубе забарвлення/ /зелене забарвлення/ /безбарвна/
Під концентрацією розчину розуміють масу або об’єм розчиненої речовини, що міститься в певній масі або об’ємі розчину.
Розчинність речовини виражають за допомогою коефіцієнта розчинності, який відповідає кількості грамів речовини, яку можна розчинити в 1 л води при даній температурі.
Розрізняють масову й об’ємну концентрацію.
Масова концентрація вказує кількість грамів речовини, що міститься в певній масі розчину, і виражається як масова частка розчиненої речовини.
Під масовою часткою розуміють співвідношення маси розчиненої речовини mреч. і розчину mр:

Якщо частка маси виражається в процентах, то співвідношення множиться на 100%:
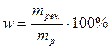 .
.
 |
Приклад. Визначити масову частку хлориду натрію в розчині, що утворюється при розчиненні 20 г NaCl у 180 г води. Визначаємо масу розчину і підставляємо це значення в формулу:
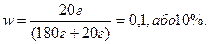
Під молярністю розчину розуміють кількість молів розчиненої речовини, що міститься в 1000 г розчину. Наприклад, якщо в 1000 г розчину 2 моль сірчаної кислоти, то розчин буде двомольним.
Молярна концентрація – це відношення кількості речовини, що міститься в розчині, до об’єму розчину.
Молярну концентрацію обчислюють за формулою
 ,
,
де  - кількість молів розчиненої речовини;
- кількість молів розчиненої речовини;
v – об’єм розчину.
Приклад. Визначити молярну концентрацію розчину їдкого натру, якщо в 200 мл розчину міститься 0,5 моль NaOH/
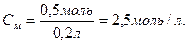
Молярна концентрація еквівалента – це відношення кількості речовини еквівалента, що міститься в розчині, до об’єму цього розчину. Розраховують за формулою
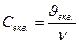 ,
,
де 
 - кількість молів еквівалента;
- кількість молів еквівалента;
 - об’єм розчину, л.
- об’єм розчину, л.
Під еквівалентом речовини розуміють таку її кількість, яка взаємодіє з однією масовою частиною водню або заміщує її при хімічних реакціяї.
Для визначення молярної маси еквівалента основи молярну масу основи розподіляють на кількість гідроксильних груп. Наприклад:
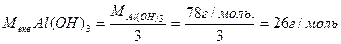
Для визначення молярної маси еквівалента кислоти молярну масу її розподіляють на кількість атомів водню. Наприклад:
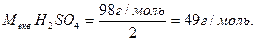
Молярна маса еквівалента солі дорівнює відношенню молярної маси солі до добутку валентності металу на кількість його атомів. Наприклад:


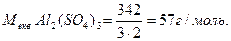
Приклад. Визначити молярну концентрацію еквівалента розчину сульфату міді (ІІ) творився при розчиненні розчиненні20 г СиSO4
у 500 мл розчинника.
Визначаємо молярну масу еквівалента СиSO4:

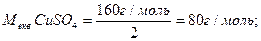

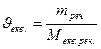 ;
;
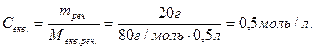
Використання молярної концентрації еквівалента спрощує розрахунки. Речовини взаємодіють між собою в кількостях, що дорівнюють їхнім еквівалентам. Це означає, що один еквівалент кислоти взаємодіє з одним еквівалентом лугу під час реакції нейтралізації, утворюючи при цьому один еквівалент солі й один еквівалент води:
Н2SO4 + 2NaOH = Na2SO4 + 2H2O.
Знаючи молярну концентрацію еквівалента й еквівалент розчиненої речовини, легко визначити масу речовини, що міститься в 1 мл розчину. Для цього необхідно масу розчиненої речовини поділити на 1000. Ця величина називається титром (Т):
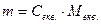 ;
;
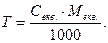
Приклад. Обчислити титр розчину NaOH з молярною концентрацією еквівалента 2 моль/л:
Секв. = 2 моль/л; Мекв(.NaOH) = M NaOH = 40 г/моль;

Розчин з відомим титром називається титрованим. Для приготування титрованого розчину необхідно взяти точну наважку речовини, розчинити її в мірній колбі у воді та долити воду до потрібного об’єму.
 Користуючись титрованим розчином лугу, можна визначити молярну концентрацію еквівалента. Оскільки розчин з однаковою молярною концентрацією еквівалента містить однакові кількості еквівалентів, то ці розчини реагують між собою в об’ємному співвідношенні 1:1. При різних концентраціях речовини реагують між собою в об’ємах, обернено пропорційних їхнім концентраціям:
Користуючись титрованим розчином лугу, можна визначити молярну концентрацію еквівалента. Оскільки розчин з однаковою молярною концентрацією еквівалента містить однакові кількості еквівалентів, то ці розчини реагують між собою в об’ємному співвідношенні 1:1. При різних концентраціях речовини реагують між собою в об’ємах, обернено пропорційних їхнім концентраціям: 
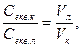
де Секв. к і Секв. л – відповідно молярні концентрації еквівалентів кислоти та лугу;
Vл і Vк – відповідно об’єми лугу та кислоти.
Метод титрування широко використовується в аналітичній, біологічній хімії при проведенні біохімічних аналізів.
Для розчинів характерні явища осмосу і дифузії. Під дифузією розуміють самочинне перенесення речовини з розчину з більшою концентрацією в розчин із меншою концентрацією.
Якщо на межі поділу розчин-розчинник встановити напівпроникну перетинку, то крізь неї дифундуватиме тільки розчинник.
Однобічна дифузія називається осмосом. Внаслідок осмосу збільшується об’єм розчину. При цьому створюється додатковий тиск, який називається осмотичним. Осмотичний тиск залежить від концентрації розчину і температури.
Я.Х. Вант – Гофф встановив математичну залежність між тиском, концентрацією і температурою розчину:
р =СмRT,
де р – осмотичний тиск;
Cм – молярна концентрація;
R –універсальна газова стала (8,3151 Дж/моль К);
T –абсолютна температура.
Поєднання цього рівняння з рівнянням стану ідеальних газів Клайперона-Менделєєва призвело до відкриття закону Вант-Гоффа: осмотичний тиск розбавленого розчину дорівнює такому тиску, який створювала б розчинена речовина, якби вона перебувала у вигляді газу, і при такій самій температурі займала такий самий об’єм, як і розчин.
Виходячи з цього закону, ми можемо визначити тиск, об’єм, масу розчиненої речовини, температуру розчину, оскільки:
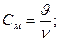

Підставивши ці значення в рівняння Вант-Гоффа, дістанемо такий вираз:
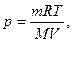
де р – осмотичний тиск розчину;
m – маса розчиненої речовини;
М – молекулярна маса розчиненої речовини;
V - об’єм розчину. Осмос має велике значення в життєдіяльності людини, тварин і рослин. Надходження води та поживних речовин з грунту в рослини, пружність рослинних і тваринних клітин, рух крові по кровоносних судинах – все це вияв осмосу.
У концентрованих розчинах вода дифундує з клітин у розчин, клітини при цьому втрачають воду, а також, і пружність, рослини при цьому в’януть, тваринні організми вимирають, порушуються біохімічні процеси. Це явище називається плазмолізом.
Осмотичний тиск крові та лімфи людини становить близько 0,8 МПа.
Теорія електролітичної дисоціації
У 1867 р. С. Арреніус висунув гіпотезу, що при розчиненні у воді молекули речовини розпадаються на позитивно (катіони) і негативно (аніони) заряджені частинки. Ця гіпотеза лягла в основу теорії електролітичної дисоціації.
Із сучасної точки зору суть теорії електролітичної дисоціації полягає в тому, що:
1) при розчиненні в полярних розчинниках (і деяких неполярних) електроліти частково або повністю розпадаються на іони:
2) дисоціації піддаються речовини з іонним та полярним ковалентним зв’язками.
Якщо розчиняється речовина з іонним типом зв’язку, то полярні молекули води орієнтуються навколо цих іонів. Завдяки силам взаємодії, що виникають між іонами і молекулами води, зв’язки між іонами розчиненої речовини розриваються і в розчині з’являються гідратовані іони.
При розчиненні речовин з ковалентним полярним типом зв’язку виникають сили взаємодії між полярними молекулами розчиненої речовини і розчинника, внаслідок чого послабляються зв’язки в полярній молекулі, що зумовлює утворення іонів. На цей процес спливає діелектрична стала розчинника 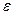 . Чим вона вища, тим легше послаблюється зв’язок між іонами.
. Чим вона вища, тим легше послаблюється зв’язок між іонами.
Електрична дисоціація здебільшого є оборотним процесом. Взаємодія між молекулами або іонами розчинюваної речовини і молекулами розчинника називається сольватацією. Вона може складатись з декількох процесів: молекулярної дісоціації, утворення сольватів (продуктів сольватації), іонізації й електролітичної дисоціації. Молекулярна дисоціація має місце, коли розчинювана речовина існує у вигляді асоціатів, які при розчиненні розпадаються на окремі молекули.
 Однією з характерних ознак процесу дисоціації при великому розбавленні є ступінь дисоціації
Однією з характерних ознак процесу дисоціації при великому розбавленні є ступінь дисоціації  . Ступінь дисоціації показує, скільки молекул із загальної їх кількості розщепилося на іони:
. Ступінь дисоціації показує, скільки молекул із загальної їх кількості розщепилося на іони:

де n  – кількість молекул, що розщепились;
– кількість молекул, що розщепились;
N –загальна кількість молекул.
Величина ступеня дисоціації залежить від концентрації розчиненої речовини і температури. Тому кількісною характеристикою електролізу вважають константу електролітичної дисоціації К, яка залежить від температури і природи розчиненої речовини.
Константа дисоціації – це відношення добутку концентрацій іонів у розчині до концентрації недисоційованих молекул.
В. Оствальд встановив залежність між константою К, ступенем дисоціації і молярною концентрацією розчину:
 .
.
Для дуже слабких електролітів знаменник є малою величиною, якою можна знехтувати.
Тому закон Оствальд для таких розчинів можна записати так:
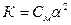 ,
,
звідки
 .
.
За значенням константи дисоціації електроліти поділяють на сильні й слабкі. Але такий поділ умовний, оскільки чіткої межі між ними не існує. Такий поділ відображає стан речовин, а не природу сполук. Залежно від різних факторів речовина може виявляти властивості як слабкого, так і сильного електроліту.
У розчинах слабких електролітів процес дисоціації проходить тільки частково і в розчинах встановлюється динамічна рівновага між недисоційованими молекулами та іонами. Для таких розчинів застосований закон діючих мас.
Так, для оцтової кислоти, яка дисоціює за схемою
СН3СООН = СН3СОО- + Н+,
Константа рівноваги дорівнює константі дисоціації
 .
.
Константу рівноваги процесу дисоціації називають також константою дисоціації. Вона залежить від природи розчинюваної речовини і розчинника, від температури, але не залежить від концентрації розчину. З підвищенням температури константа дисоціації, як правило, зменшується.
Згідно з принципом Ле Шательє, така температурна залежність вказує на екзотермічність процесу дисоціації.
Константа дисоціації є важливою характеристикою слабких електролітів, оскільки характеризує міцність їх молекул у даному розчині.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 698; Нарушение авторских прав?; Мы поможем в написании вашей работы!