
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Паливні елементи
|
|
|
|
Різновидом гальванічних елементів є паливні елементи. У цих елементах електрична енергія утворюється за рахунок реакції окислення палива (наприклад, водню). Окислювач і відновник безперервно подаються в систему зовні. Широкого поширення набули воднево-кисневі паливні елементи. У цих елементах використовуються нікелеві електроди, занурені в розчин гідроксиду калію, до електродів постійно подаються газоподібні водень і кисень. Схема такого елемента записується так:
 .
.
Під час роботи елемента водень окислюється, а кисень відновлюється за участю молекул води з утворенням гідроксид-іонів:
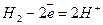 ;
; 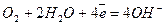 .
.
Сумарний процес, що відбувається під час роботи паливного елемента,  є реакцією горіння водню:
є реакцією горіння водню:
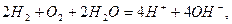 або
або 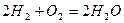 .
.
Паливні елементи мають високу ефективність, однак суттєвим недоліком їх є незручність транспортування і зберігання палива (особливо водню). Незважаючи на це, паливні елементи знайшли широке застосування.
Акумулятори.
 Як джерела постійного струму ефективні та зручні в роботі електричні акумулятори – гальванічні елементи багаторазового використання.
Як джерела постійного струму ефективні та зручні в роботі електричні акумулятори – гальванічні елементи багаторазового використання.
Розглянемо роботу таких джерел струму на прикладі свинцевого акумулятора. Він складається із занурених у розчин сірчаної кислоти свинцевого електрода та електрода із свинцю, вкритого шаром оксиду свинцю (1V) РвО2 (окислювач). Під час роботи акумулятора на електроді без покриття відбувається реакція окислення:
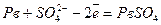 .
.
На електроді, вкритому окислювачем, відбувається процес відновлення:
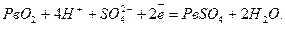
Сумарна реакція запишеться так:
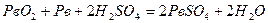 .
.
Пропускаючи електричний струм крізь відпрацьований (розряджений) акумулятор, його можна знову повністю регенерувати (зарядити). Процес зарядження складається з таких реакцій:
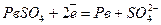 ;
;
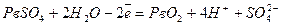
-----------------------------------------------------------------------------------------
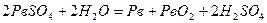 .
.
У результаті процесу зарядження акумулятора сульфат свинцю (ІІ) видаляється з електродів і вони набувають вихідні форми.
ЕЛЕКТРОЛІЗ РОЗЧИНІВ І РОЗПЛАВІВ
Електролізом називають сукупність хімічних процесів, що відбуваються під дією електричного струму на електродах, занурених у розчин або розплав електроліту.
Електроліз проводять у спеціальних пристроях- електролізерах, або електролітичних ваннах. У розчин або розплав електроліту занурюють два струмопровідних електроди, які сполучають із джерелом електричного струму. Під дією джерела струму на одному з електродів виникає надлишок електронів (негативний електрод, позначається знаком -), на другому – нестача електронів (позитивний електрод, позначається знаком +). У електричному полі іони, що місяться у розчині або розплаві внаслідок дисоціації електроліту, набувають спрямованого руху: катіони переміщуються до негативного електрода, аніони – до позитивного.
 Частинки з розчину або розплаву (іони, молекули), що перебувають поблизу негативного електрода, приймають електрони, тобто відновлюються. Електрод, на якому відбувається відновлення, називається катодом. Частинки, що перебувають поблизу позитивного електрода, віддають електрони, тобто окислюються. Електрод, на якому відбувається окислення, називається анодом.
Частинки з розчину або розплаву (іони, молекули), що перебувають поблизу негативного електрода, приймають електрони, тобто відновлюються. Електрод, на якому відбувається відновлення, називається катодом. Частинки, що перебувають поблизу позитивного електрода, віддають електрони, тобто окислюються. Електрод, на якому відбувається окислення, називається анодом.
Електролізу можуть піддаватися і розчини, і розплави речовин, зокрема розплави солей і лугів.
Електродами для електролізу можуть бути різні електропровідні матеріали. У ході електролізу електроди можуть залишатися без змін, тобто не окислюватись під дією електричного струму. Такі електроди називаються інертними (нерозчинними). Як матеріал для інертних анодів звичайно використовують платину або графіт. Існують також аноди, що окислюються (розчинні), наприклад, мідні й нікелеві. Електроди обох типів застосовуються на практиці.
Електроліз розплавів з інертним анодом.
Під час електролізу розплавленої солі або лугу з інертним анодом на катоді завжди відновлюються катіони металу, а на інертному аноді окислюються аніони кислотного залишку (електроліз розплаву солей) або гідроксид-аніони (електроліз розплавів лугів). Розглянемо конкретні приклади електролізу розплавів з інертними анодами.
1. Електроліз розплаву хлориду калію. У розплаві сіль дисоціює на іони:
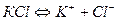 .
.
На катоді відновлюються катіони калію, а на аноді окислюються хлорид-іони:
Катод (-) 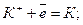
Анод (+) 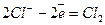 .
.
Зрівнявши число електронів, що беруть участь у катодному й анодному процесах, можна записати сумарну реакцію:
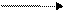
 2К+ + 2Сl-електроліз 2К +Сl2,або 2КСlелектроліз 2К + Сl2.
2К+ + 2Сl-електроліз 2К +Сl2,або 2КСlелектроліз 2К + Сl2.
Отже, під час електролізу розплаву КСl на катоді виділятиметься металічний калій, на аноді – хлор.
2. Електроліз розплаву сульфату натрію. У розплаві сіль  дисоціює на іони:
дисоціює на іони:
Na2SO4 = 2Na+ + SO42-.
 |
На електродах відбувається відновлення Na+ і окислення SO42-
 |
Катод (-) 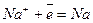 4
4
Анод (+) 
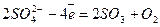 1
1
----------------------------------------------------------------------------------------
 4Na+ +2SO42- електроліз 4Na + 2 SO3 +O2,
4Na+ +2SO42- електроліз 4Na + 2 SO3 +O2,
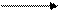 або Na2SO4електроліз 4Na + 2 SO3 +O2.
або Na2SO4електроліз 4Na + 2 SO3 +O2.
 3. Електроліз розплаву гідроксиду калію. Рівняння дисоціації гідроксиду:
3. Електроліз розплаву гідроксиду калію. Рівняння дисоціації гідроксиду:
 .
.
Рівняння реакцій, що відбуваються на електродах:
 Катод (-)
Катод (-) 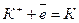 4
4
Анод (+) 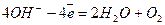 1
1
----------------------------------------------------------------------------------------
 4К+ + 4ОН- електроліз 4К + 2 Н2О + О2,
4К+ + 4ОН- електроліз 4К + 2 Н2О + О2,
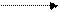 або 4КОН електроліз 4К +2Н2О + О2.
або 4КОН електроліз 4К +2Н2О + О2.
Отже, під час електролізу розплавів солей та лугів на катоді осаджується метал, що має важливе практичне значення.
Електроліз водних розчинів з інертним анодом.
Під час електролізу водних розчинів електролітів на електродах одночасно з розрядженням катіонів і аніонів або замість них можуть відновлюватись або окислюватись молекули води.
Щоб визначити, які частинки беруть участь у катодному процесі, зручно скористатися рядом стандартних електродних потенціалів. Залежно від значення електродного потенціалу можливі три варіанти перебігу електроліту:
1) якщо в розчині містяться потенціалвизначальні іони електродів з Е0 < - 1,18 В, наприклад іони К+, Са+2, Аl+3, то вони не відновлюватимуться у водному розчині, оскільки легше, ніж вони, відновлюються молекули води:
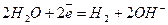 ;
;
2) якщо в розчині містяться іони Н+, Си2+, Аg+ та інших електродів з Е0>0, то вони легко відновлюються, наприклад:

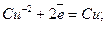
3) у розчині, що містить потенціалвизначальні іони електродів з
-1,18 <Е0<0, при електролізі відбуваються паралельно два процеси – відновлення катіонів металу і молекул води, наприклад:
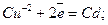
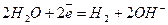 .
.
При цьому більша частина з усієї кількості електрики витрачається, як правило, на відновлення іонів металу.
В анодному процесі можуть брати участь аніони деяких безкисневих кислот Сl-, Вr-, І-, S2- та гідроксид-іони ОН- (розряджаються тільки ці аніони), наприклад:
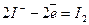 ;
; 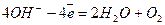 .
.
Якщо в розчині містяться аніони F-, SO42-, NO3-, PO43-,CO32- та деякі інші, то окисленню піддається тільки вода:

 .
.
Розглянемо кілька прикладів електролізу водних розчинів електролітів з нерозчинними анодами.
1. Електроліз водного розчину хлориду міді (І) з графітовими електродами. У водному розчині сіль дисоціює на іони:
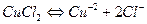 .
.
Оскільки Е0(Си2+/Си) = 0,34 В, то на катоді відновлюватимуться тільки іони міді, на аноді окислюватимуться хлорид-іони:
Катод (-) 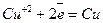
Анод (+) 
-----------------------------------------------------------------------------------------

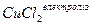

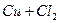 .
.
2. Електроліз водного розчину сульфату нікелю (ІІ) з інертним анодом. Рівняння дисоціації солі:
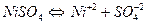 .
.
Оскільки Е0(Nі+2/Nі) = - 0,25 В, на катоді відбуватимуться два процеси – відновлення катіонів нікелю і молекул води; на аноді окислюватиметься вода:
Катод (-) 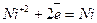 ,
, 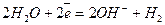 ,
,
Анод (+) 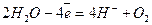 .
.
Сумарну реакцію в цьому прикладі записати не можна, оскільки невідомо, яка частина із загальної кількості електрики витрачається на відновлення води, а яка – на розрядження іонів нікелю.
3. Електроліз водного розчину нітрату калію з інертним анодом. Рівняння дисоціації солі:
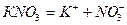 .
.
Оскільки Е0(К+/К) = -2,91 В, катіони К+ не відновлюватимуться, аніони NO3 не окислюватимуться у водних розчинах. У результаті на катоді і на аноді будуть відновлюватись і окислюватись молекули води, а електроліт (сіль) необхідний тільки для забезпечення електропроводністі розчину. Рівняння реакцій, що відбуватимуться на електродах:
 Катод (-)
Катод (-) 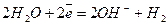 2
2
Анод (+)  1
1
----------------------------------------------------------------------------------------

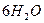 електроліз
електроліз 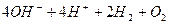 ,
,
 або
або 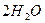 електроліз
електроліз 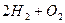 .
.
4. Електроліз водного розчину гідроксиду натрію з інертним анодом. Рівняння дисоціації лугу в розчині:
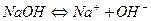 .
.
 Оскільки Е0(Na+ / Na) = -2,71 В, на катоді відновлюватимуться молекули води, а на аноді окислюватимуться ОН- іони:
Оскільки Е0(Na+ / Na) = -2,71 В, на катоді відновлюватимуться молекули води, а на аноді окислюватимуться ОН- іони:
 Катод (-)
Катод (-) 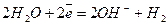 2
2
Анод (+) 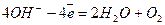 1
1
----------------------------------------------------------------------------------------

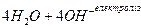
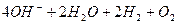 ,
,
 або
або 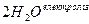
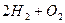 .
.
Електроліз з розчинним анодом. Іноді електроліз проводять з електродами металів, які в ході процесу можуть окислюватись(розчинюватись). Як такі електроди –метали використовуються, наприклад, мідь, нікель, кобальт, кадмій, олово. У цьому випадку на аноді відбувається окислення металу, а процес на катоді відбувається так само, як і під час електролізу з інертними анодами. Слід тільки враховувати можливість появи у розчині нових катіонів при окисленні анода.
Як приклад, розглянемо електроліз водного розчину сульфату кадмію з кадмієвими електродами 5Е0(Сd+2/Cd)= 0,40 В. Отже, на катоді відновлюватимуться іони Сd+2, а на аноді окислюватиметься матеріал анода- кадмій:
Катод (-) 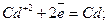
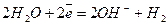 ;
;
Анод (+) 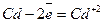 .
.
Отже, метал, що розчиняється на аноді (розчинний анод), знову осаджується на катоді.
Застосування електролізу в промисловості. Електроліз знаходить широке застосування в багатьох галузях промисловості.
У хімічній промисловості електроліз використовують для добування багатьох речовин: водню, кисню, хлору, фтору, хлорної кислоти НСlО4, перманганату калію КМпО4 та інших неорганічних і органічних сполук. Наприклад, для добування фтору проводять електроліз фтороводню:
Катод (-) 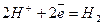 ;
;
Анод (+) 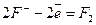 ;
;
-----------------------------------------------------------------------------------------

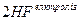
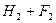 .
.
 У металургії електроліз застосовують для добування та очищювання металів, Наприклад, електролізом водних розчинів солей добувають цинк, кадмій, марганець, нікель, олово, залізо. Цей метод широко використовують для добування металів з високим ступенем чистоти електролітичною очисткою технічних металів. Електролізом розплавів сполук добувають алюміній, магній, натрій, кальцій та інші метали.
У металургії електроліз застосовують для добування та очищювання металів, Наприклад, електролізом водних розчинів солей добувають цинк, кадмій, марганець, нікель, олово, залізо. Цей метод широко використовують для добування металів з високим ступенем чистоти електролітичною очисткою технічних металів. Електролізом розплавів сполук добувають алюміній, магній, натрій, кальцій та інші метали.
Для очищювання технічних металів використовують метод електрорафінування, що базується на електролізі з розчинним анодом. Наприклад, зразок технічної міді, що підлягає очистці, вміщують в електролізер з розчином сульфату міді (ІІ) і підключають до нього позитивний полюс джерела струму, мідь стає анодом. Як катод використовується очищена мідь. У ході електролізу технічна мідь (анод) окислюється з утворенням катіонів міді(ІІ), які переміщуються до катода та відновлюються. У результаті на катоді осаджується чистий метал (електролітична мідь).
Крім міді методом електрорафінування очищають нікель, кобальт, кадмій, а електрорафінуванням у розплавах – алюміній та магній.
За допомогою електролізу наносять металічні захисні та декоративні покриття з хрому, нікелю, цинку, кадмію, міді та інших металів. Ця галузь застосування електролізу називається гальваностегією. Електроліз застосовують також для виготовлення деталей потрібної форми (електрохімічна обробка металів).
КОРОЗІЯ МЕТАЛІВ
На практиці під час експлуатації виробів із металів та інших сплавів доводиться стикатися з явищем руйнування їх під дією зовнішнього середовища. Руйнування металів і сплавів внаслідок взаємодії їх із навколишнім середовищем називається корозією.
Корозія металів наносить великих економічних збитків. У результаті корозії металів виходять з ладу устаткування, машини, механізми, руйнуються металічні конструкції. Особливо інтенсивно піддається корозії апаратура хімічної промисловості, яка контактує з агресивними хімічними середовищами. Тому розробка методів захисту металів від корозії – важлива проблема сучасної хімії.
Корозійне руйнування може поширюватись на всю поверхню металу – суцільна або загальна корозія. Залежно від механізму процесу руйнування розрізняють хімічну та електрохімічну корозії.
Хімічна корозія. Хімічна корозія розвивається при контакті металу з розчинами неелектролітів або з газами при високих температурах (її називають також газовою корозією). Це поширений вид корозії апаратури в хімічній промисловості.
Під час хімічної корозії відбувається безпосереднє окислення металу окислювачами – компонентами навколишнього середовища. Найнебезпечнішими для металів компонентами газового середовища є кисень О2, водяна пара Н2О, оксид вуглецю (1V) СО2, оксид сірки (1V) SO2. Корозійне руйнування заліза та його сплавів у атмосфері кисню зумовлене перебігом реакції

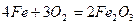 .
.
З підвищенням температури швидкість газової корозії зростає. Електрохімічна корозія. Часто корозія металу розвивається при контакті його з розчинами електролітів. На практиці цей випадок має місце при зануренні металевих виробів у водні розчини, морську воду, у грунт з протічними грунтовими водами, при конденсації на металі вологи з атмосфери. Така корозія відбувається, як правило, за електрохімічним механізмом. Під час електрохімічної корозії на металі відбувається одночасно два процеси – окислення металу Ме (анодний процес) 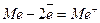
і відновлення окислювачів-компонентів середовища Ох (катодний процес) 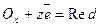 .
.
У результаті окислення металу відбувається його розчинення. Як правило, окислювачами у водних розчинах у кислому середовищі є іони водню Н+ або розчинений у воді кисень повітря. Так, корозія у кислому середовищі супроводжується таким катодним процесом:
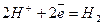 .
.
 Катодний процес під час корозії з участю кисню відбувається за рівнянням
Катодний процес під час корозії з участю кисню відбувається за рівнянням
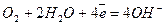 .
.
Як приклад, розглянемо реакції, що відбуваються під час електрохімічної корозії заліза. Якщо корозія відбувається у розчині кислоти (рН<7), то проходять такі реакції

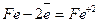 1
1
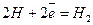 1
1
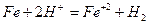 .
.
Корозія заліза в нейтральному або лужному середовищі характеризується такими реакціями:


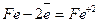 2
2
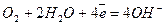 1
1
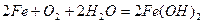 .
.
Гідроксид заліза (ІІ), що утворюється, легко окисляється киснем повітря:
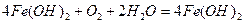 .
.
Продукт корозії заліза – бура іржа – є складовою сумішшю гідроксидів заліза (ІІ) і заліза (ІІІ), продуктів їх розкладання і взаємодії з оксидом вуглецю (ІV) та іншими речовинами навколишнього середовища.
Метали, що мають позитивний стандартний електродний потенціал піддаються корозії тільки за участю кисню в усіх середовищах. Наприклад, процес корозії міді у середовищі з будь-якою кислотністю відбувається згідно з таким рівнянням:

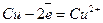 2
2

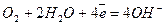 1
1
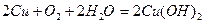 .
.
Електрохімічна корозія має багато різновидів. Основними з них є: а) атмосферна корозія, що відбувається на поверхні металу під дією сконденсованої вологи. Ця волога розчиняє домішки з повітря: оксиди азоту, оксид сірки (ІV), хлороводень тощо, які прискорюють корозію; б) грунтова корозія, що відбувається при контакті металів з грунтовими водами (трубопроводи, кабелі, рейки); в) морська корозія, що відбувається при контакті металів з морською водою (обшивка кораблів, устаткування, що застосовується в портах).
Тема 7 Метали
Класифікація металів. Фізичні та хімічні властивості металів. Розповсюдження металів в природі. Методи отримання металів із руд. Основні методи отримання металів високої чистоти. Сплави. Лужні й лужноземельні метали – властивості, найважливіші сполуки, застосування ВЛАСТИВОСТІ МЕТАЛІВ
Метали та їхні сплави є основними конструкційними матеріалами в машинобудуванні та приладобудуванні. Метали використовують, як електротехнічні матеріали з високою електропровідністю, як провідникові (Си, Аl) з високою намагнічуваністю, як магнітні (Fe, Nі).
До конструкційних і електротехнічних металів ставлять певні вимоги стосовно їхніх фізичних (електропровідність, міцність) та хімічних (відношення до кисню, води, кислотам, лугам) властивостей.
Лужні й лужноземельні метали не можна використовувати як конструкційні або електротехнічні через високу хімічну активність та низьку міцність. Застосування деяких металів сьогодні обмежено внаслідок високої вартості.
Характерною хімічною властивістю є їхня здатність до відновлення.
Металам притаманні такі фізичні властивості:
високі теплопровідність і електропровідність, здатність відбивати світло, пластичність, ковкість тощо.
Схожість фізико-хімічних властивостей металів зумовлена спільністю будови їхніх атомів та природою хімічного зв’язку. Усі метали на зовнішньому енергетичному рівні мають невелику кількість електронів та значну кількість вільних атомних орбіталей. Валентні електрони з незначною енергією іонізації вільно пересуваються по орбіталях сусідніх атомів, здійснюючи зв’язок між ними. Метал можна розглядати як щільно упаковану структуру з катіонів (кістяків атомів), зв’язаних колективізованими електронами (електронний газ). У d-металів частина валентних електронів виявляється локалізованою, вона здійснює направлені ковалентні зв’язки між сусідніми атомами. Цим пояснюються більш високі температури плавлення і кипіння d-металів порівняно з лужними й лужноземельними металами.
Хімічні властивості металів визначаються будовою їхніх електронних оболонок.
S-метали виявляють сталий ступінь окислення та основний характер оксидів (за винятком Ве, який має малий радіус атома при двохелектронному внутрішньому шарі). S –метали утворюють солеподібні гідриди; гідриди Ве і Мg є полімерними і несталими. Збудження атомів можливе лише у S-металів головної підгрупи другої групи періодичної системи з наступною SР – гібридизацією орбіталей.
Р-метали виявляють змінний ступінь окислення. Їхні оксиди атмосферні (крім Іп і Тl). Гідриди Р-металів є полімерними і газоподібними, а тип гібридизації орбіталей –SP2.
d-метали утворюють хімічні зв’язки за рахунок S і d –електронів, виявляючи перемінний ступінь окислення. У нижчому ступені окислення оксиди d-металів мають основний, у проміжному – амфотерний, а у вищому – кислотний характер. Гідриди d-металів являють собою кристалічні речовини з металічною провідністю. У гібридизації орбіталей беруть участь S-, P- і d- орбіталі.
Більшість металів у звичайних умовах стійкі до дії кисню повітря. На поверхні таких металів утворюються досить міцні оксидні плівки, які запобігають подальшому окисленню. Проте з підвищенням температури швидкість реакції металів з киснем зростає, при високих температурах більшість металів взаємодіє з киснем повітря. Особливо інтенсивно реагують з киснем магній та деякі його сплави.
Лужні й лужноземельні метали активно реагують з водою:
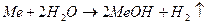
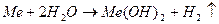
Деякі метали в присутності вологи окислюються під дією кисню повітря (корозія чавунів та сталей).
У гарячій воді руйнуються магній та деякі його сплави:
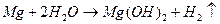 .
.
Більшість інших металів при звичайних умовах стійкі до дії води. Це пояснюється їхньою малою хімічною активністю (Си, Аg,
Аи, Рt) або захисною дією поверхневих оксидних плівок (Аl, Tl).
Метали, що стоять в ряду активності до водню, реагують з водними розчинами кислот (НСl, H2SO4, H3PO4) з виділенням водню:
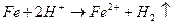 .
.
 Більш сильні окислювальні властивості порівняно з іонами Н+, посідають азотна й концентрована сірчана кислоти.
Більш сильні окислювальні властивості порівняно з іонами Н+, посідають азотна й концентрована сірчана кислоти.
Під їх дією окислюються неактивні метали, наприклад: 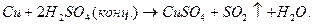
Явище глибокого гальмування окислення металу, зумовлене появою на його поверхні захисних або сольових плівок, називається пасивацією. Пасивацією пояснюється стійкість низки металів до дії розчинів концентрованих кислот, окислювачів або їх солей.
З розчинами лугів реагують метали з виразними амфотерними властивостями (Ве, Zn, Al):
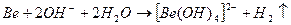 .
.
Більш активні метали витискують менш активні з розчинів їх солей: 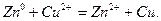
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1045; Нарушение авторских прав?; Мы поможем в написании вашей работы!