
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Контрольні питання. 1 Напишіть електронні формули атомів елементів із порядковими номерами 9 і 28
|
|
|
|
1 Напишіть електронні формули атомів елементів із порядковими номерами 9 і 28. Покажіть розподіл електронів цих атомів по орбіталях. До якого електронного сімейства відноситься кожний з цих елементів?
2 Напишіть електронні формули атомів елементів із порядковими номерами 16 і 26. Розподіліть електрони цих атомів по орбіталях. До якого електронного сімейства відноситься кожний з цих елементів?
3 Яке максимальне число електронів можуть займати s-, р-, d- і f-орбіталі даного енергетичного рівня? Чому? Напишіть електронну формулу атома елемента з порядковим номером 31.
4 Напишіть електронні формули атомів елементів із порядковими номерами 25 і 34. До якого електронного сімейства відноситься кожний з цих елементів?
5 Які орбіталі атома заповнюються електронами раніше: 4s чи 3d; 5s чи 4р? Чому? Напишіть електронну формулу атома елемента з порядковим номером 21.
6 Ізотоп нікелю-57 утвориться при бомбардуванні a-частками ядер атомів заліза-54. Складіть рівняння цієї ядерної реакції і напишіть його в скороченій формі.
7 Які орбіталі атома заповнюються електронами раніше: 4d чи 5s; 6s чи 5р? Чому? Напишіть електронну формулу атома елемента з порядковим номером 43.
8 Що таке ізотопи? Чим можна пояснити, що в більшості елементів періодичної системи атомні маси виражаються дробовим числом? Чи можуть атоми різних елементів мати однакову масу? Як називаються подібні атоми?
9 Напишіть електронні формули атомів елементів із порядковими номерами 14 та 40. Скільки вільних d-орбіталей в атомі останнього елемента?
10 Ізотоп вуглецю-11 утвориться при бомбардуванні протонами ядер атомів азоту-14. Складіть рівняння цієї ядерної реакції і напишіть його в скороченій формі.
11 Напишіть електронні формули атомів елементів із порядковими номерами 15 і 28. Чому дорівнює максимальний спін p-електронів в атомі першого і d-електронів в атомів другого елемента?
12 Напишіть електронні формули атомів елементів із порядковими номерами 21 і 23. Скільки вільних d-орбіталей в атомах цих елементів?
13 Скільки і які значення може приймати магнітне квантове число m l при орбітальному числі l = 0, 1, 2 і 3? Які елементи в періодичній системі називають s-, р-; d- f -елементами? Наведіть приклади.
14 Які значення можуть приймати квантові числа n, l, m l і ms, що характеризують стан електронів в атомі? Які значення вони приймають для зовнішніх електронів атома магнію?
15 Які з електронних формул, що відбивають будову не збудженого атома деякого елемента є невірними: а) 1s22s22p53s1; б) 1s2,2s22p6; в) 1s22s22p63s23p63d4; г) 1s22s22p63s23p64s2; д) 1s22s22р63s2Зd2? Чому? Атомам яких елементів відповідають правильно складені електронні формули?
16 Напишіть електронні формули атомів елементів з порядковими номерами 24 та 33 із погляду на те, що у першого проходить «провал» одного 4S – електрона на 3d-підрівень. Чому дорівнює максимальний спін d-електронів в атомах першого та р-електронів в атомах другого елементів?
1.3 Енергетика хімічних процесів (термохімічні розрахунки)
При розв’язанні задач цього розділу див. таблицю 5.
Науку про взаємні перетворення різних видів енергії називають термодинамікою. Термодинаміка встановлює закони цих перетворень, а також напрямок самочинного ходу різних процесів у даних умовах.
При хімічних реакціях відбуваються глибокі якісні зміни в системі, рвуться зв'язки у вихідних речовинах і виникають нові зв'язки в кінцевих продуктах. Ці зміни супроводжуються поглинанням чи виділенням енергії. У більшості випадків цією енергією є теплота. Розділ термодинаміки, що вивчає теплові ефекти хімічних реакцій, називають термохімією. Реакції, що супроводжуються виділенням теплоти, називають екзотермічними, а ті, котрі супроводжуються поглинанням теплоти, — ендотермічними. Теплота реакції є, таким чином, мірою зміни властивостей системи, і знання її може мати велике значення при визначенні умов протікання тих чи інших реакцій.
При будь-якому процесі дотримується закон збереження енергії як прояв більш загального закону природи — закону збереження матерії. Теплота Q, поглинена системою, йде на зміну її внутрішньої енергії ΔU і на здійснення роботи А:
Q = ΔU + A.
Внутрішня енергія системи U- це загальний її запас, що включає енергію поступального й обертального руху молекул, енергію внутрішньомолекулярних коливань атомів і атомних груп, енергію руху електронів, внутрішньоядерну енергію і т.д. Внутрішня енергія — повна енергія системи без потенційної енергії, обумовленої положенням системи в просторі, і без кінетичної енергії системи як цілого. Абсолютне значення внутрішньої енергії U речовин невідомо, тому що не можна привести систему в стан, позбавлений енергії. Внутрішня енергія, як і будь-який вид енергії, є функцією стану, тобто її зміна обумовлюється початковим і кінцевим станом системи і не залежить від шляху переходу, по котрому перебігає процес ΔU = U2 – U1, де ΔU — зміна внутрішньої енергії системи при переході від початкового стану U1 у кінцевий U2. Якщо U2 >U1,to ΔU> 0. Якщо U2 <U1, то ΔU<0.
Теплота й робота функціями стану не є, тому що вони служать формами передачі енергії і зв'язані з процесом, а не зі станом системи. При хімічних реакціях А – це робота проти зовнішнього тиску, тобто в першому наближенні А = pΔV, де ΔV – зміна об’єму системи (V2 – V1). Так як більшість хімічних реакцій проходить при постійному тиску, то для ізобарно-ізотермічного процесу (p-const, Т-const) теплота
Qp=ΔU + pΔV,
Qp=(U2 - U1) + p(V2 - V1),
Qp=(U2 + pV2) - (U1 + pV1 ).
Суму U+ pV позначимо через H, тоді Qp=H2 – H1=ΔH.
Величину Н називають ентальпією. Таким чином, теплота при p=const і Т=const отримує властивість функції стану і не залежить від шляху, по якому протікає процес. Звідси теплота реакції в ізобарно-ізотермічному процесі Qр дорівнює зміні ентальпії системи (якщо єдиним видом роботи є робота розширення):
Qp=ΔН.
Ентальпія, як і внутрішня енергія, є функцією стану; її зміна (DН) визначається тільки початковими і кінцевим станами системи і не залежить від шляху переходу. Теплота реакції в ізохорно-ізотермічному процесі (V=const; Т=const), при котрому ΔV = 0, дорівнює зміні внутрішньої енергії системи:
QV=ΔU.
Теплоти хімічних процесів, що протікають при р, Т=const і V, Т=const, називають тепловими ефектами.
При екзотермічних реакціях ентальпія системи зменшується і ΔН<0 (Н2 < H1), а при ендотермічних реакціях ентальпія системи збільшується і ΔН > 0 (Н2 > H1). Надалі теплові ефекти завжди будемо виражати через ΔН.
Термохімічні розрахунки, засновані на законі Гесса (1840): сумарний тепловий ефект хімічної реакції залежить тільки від природи і фізичного стану вихідних речовин і кінцевих продуктів, але не залежить від шляху переходу.
Часто в термохімічних розрахунках застосовують наслідок із закону Гесса: тепловий ефект реакції (DНх.р.) дорівнює сумі теплоти утворення DНутв. продуктів реакції за винятком суми теплоти утворення початкових речовин з урахуванням коефіцієнтів перед формулами цих речовин у рівнянні реакції
ΔНх.р.= 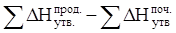 . (1)
. (1)
Приклад 1. При взаємодії кристалів хлориду фосфору (V) із парами води утвориться рідкий РОС l з і хлористий водень. Реакція супроводжується виділенням 111,4 кДж теплоти. Напишіть термохімічне рівняння цієї реакції.
Розв’язання. Рівняння реакцій, у яких біля символів хімічних сполук указуються їхні агрегатні стани або кристалічна модифікація, а також чисельне значення теплових ефектів, називають термохімічними. У термохімічних рівняннях, якщо це спеціально не обговорено, указуються значення теплових ефектів, при постійному тиску Qр, рівні зміні ентальпії системи ΔН.
Значення ΔН записують звичайно в правій частині рівняння, відокремлюючи його комою чи крапкою з комою. Прийняти такі скорочені позначення агрегатного стану речовин: г — газоподібний, р — рідкий, к — кристалічний. Ці символи не пишуть, якщо агрегатний стан речовин очевидний.
Якщо в результаті реакції виділяється теплота, то DН < 0. З огляду на сказане, складаємо термохімічне рівняння даної у прикладі реакції:
РС15(к) +Н20(г) =РОС13(р) +2НС1(г), ΔНх.р.= -111.4 кДж.
Таблиця 5 – Стандартні теплоти (ентальпії) утворення  деяких речовин
деяких речовин
| Речовина | Стан |  ,
кДж/моль ,
кДж/моль
| Речовина | Стан |  ,
кДж/моль ,
кДж/моль
|
| С2Н2 | г | +226,75 | СО | г | -110,52 |
| CS2 | г | +115,28 | СН3ОН | г | -201,17 |
| NO | г | +90,37 | С2Н5ОН | г | -235,31 |
| С6Н6 | г | +82,93 | Н2О | г | -241,83 |
| С2Н4 | г | +52,28 | Н2О | р | -285,84 |
| H2S | г | -20,15 | NH4CI | к | -315,39 |
| NH3 | г | -46,19 | СО2 | г | -393,51 |
| СН4 | г | -74,85 | Fe203 | к | -822,10 |
| С2Н6 | г | -84,67 | Са(ОН)2 | к | -986,50 |
Приклад 2. Реакція горіння етану виражається термохімічним рівнянням
С2Н6(г) +3 1/2О2 = 2СО2(г) +ЗН2О(р),
ΔНх.р.= -1559,87 кДж.
Обчислити теплоту утворення етану, якщо відомі теплоти утворення СО2(г) і Н2О(р.) (таблиця 5).
Розв’язання. Теплотою утворення (ентальпією) даної сполуки називають тепловий ефект реакції утворення 1 моль цієї сполуки з простих речовин, узятих за даних умов. Звичайно, теплоти утворення відносять до стандартного стану, тобто 25° С (298о К) і 1,013·105Па, і позначають через  . Тому що тепловий ефект із температурою змінюється незначно, то тут і надалі індекси опускаються і тепловий ефект позначається через DН. Отже, потрібно обчислити тепловий ефект реакції, термохімічне рівняння якої має вигляд
. Тому що тепловий ефект із температурою змінюється незначно, то тут і надалі індекси опускаються і тепловий ефект позначається через DН. Отже, потрібно обчислити тепловий ефект реакції, термохімічне рівняння якої має вигляд
2С(графіт) +ЗН2 (г) = С2Н6(г); ΔН =?
виходячи з таких даних:
а) С2Н6(г) +31/2О2(г) =2СО2(г) +ЗН2О(р), ΔН = -1559,87 кДж,
б) С(графіт) + О2(г) = СО2(г), ΔН = -393,51 кДж,
в) Н2(г) + 1/2 02 = Н2О(р), ΔН = -285,84 кДж.
На підставі закону Гесса з термохімічними рівняннями можна оперувати так само, як і з алгебраїчними. Для одержання шуканого результату треба рівняння (б) помножити на 2, рівняння (в) — на 3, а потім суму цих рівнянь відняти з рівняння (а):
С2Н6 +31/2О2 - 2С - 202 – ЗН2 - 3/2О2= 2СО2+ЗН2О – 2СО2 - ЗН2О,
ΔН = -1559,87 -2(-393,51) -3(-285,84) = +84,67 кДж,
ΔН = -1559,87 + 787,02 + 857,52; С2Н6= 2С + 3Н2,
ΔН = +84,67 кДж.
Тому що теплота утворення дорівнює теплоті розкладання з протилежним знаком, то
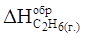 = - 84,67 кДж.
= - 84,67 кДж.
До того ж результату прийдемо, якщо для розв’язання задачі (г) використаємо наслідок із закону Гесса:
 .
.
З огляду на те, що теплоти утворення простих речовин умовно прийняті рівними нулю,
ΔН(С2Н6) = 2ΔН(СО2) + 3ΔН(Н2О) – ΔНх.р.,
ΔН(С2Н6) = 2 (-393,51) + 3 (-285,84) + 1559,87 = -84,67,
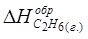 = - 84,67 кДж.
= - 84,67 кДж.
Приклад 3. Реакція горіння етилового спирту виражається термохімічним рівнянням
С2Н5 ОН(р) +ЗО2(г) =2СО2(г) +ЗН20(р), ΔН=?
Обчислити тепловий ефект реакції, якщо відомо, що мольна (молярна) теплота паротворення С2Н5 ОН(р) дорівнює +42,36 кДж і відомі теплоти утворення: С2Н5 ОН(г); СО2(г); Н2(р) (див. таблицю 5).
Розв’язання. Для визначення ΔН реакції необхідно знати теплоту утворення С2Н5 ОН(р). Останню знаходимо з даних:
С2Н5 ОН(р)=С2Н5 ОН(г), ΔН = +42,36 кДж.
+42,36= -235,31 - ΔН С2Н5ОН (р),
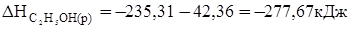 .
.
Обчислюємо ΔН реакції, застосовуючи наслідок з закону Гесса:
ΔНх.р. = 2 (-393,51) + 3 (-285,84) + 277,67 = -1366,87 кДж.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1383; Нарушение авторских прав?; Мы поможем в написании вашей работы!