
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічна спорідненість
|
|
|
|
При розв’язанні задач цього розділу див. таблиці 5 – 7.
Самочинно можуть протікати реакції, що супроводжуються не тільки виділенням, але і поглинанням теплоти.
Реакція, що йде при даній температурі з виділенням теплоти, при іншій температурі проходить із поглинанням теплоти. Тут виявляється діалектичний закон єдності й боротьби протилежностей. З одного боку, система прагне до упорядкування (агрегації), до зменшення Н; з іншого боку, система прагне до безладдя (дезагрегації). Перша тенденція зростає зі зниженням, а друга - із підвищенням температури. Тенденцію до безладдя характеризує величина, яку називають ентропією.
Ентропія S, так само як внутрішня енергія U, ентальпія Н, об’єм V та ін., є властивістю речовини, пропорційною його кількості. Ентропія відображає рух часток речовини і є мірою невпорядкованості системи. Вона зростає зі збільшенням руху часток: при нагріванні, випаровуванні, плавленні, розширенні газу, при ослабленні чи розриві зв'язків між атомами і т.п. Процеси, зв'язані з упорядкованістю системи: конденсація, кристалізація, стиск, зміцнення зв'язків, полімеризація і т.п., — ведуть до зменшення ентропії. Ентропія є функцією стану, тобто її зміна (DS) залежить тільки від початкового (S1) і кінцевого (S2) стану і не залежить від шляху процесу:
ΔG = (H2 – H1) – (TS2 – TS1), ΔG = ΔH – ΔS. (2)

 Якщо S2>S1, то ΔS>0. Якщо S2<S1, то ΔS<0.
Якщо S2>S1, то ΔS>0. Якщо S2<S1, то ΔS<0. 
Оскільки ентропія зростає з підвищенням температури, то можна вважати, що міра безладдя»Т·DS. Ентропія виражається в Дж/(моль·K). Таким чином, рушійна сила процесу складається з двох сил: прагнення до упорядкування (Н) і прагнення до безладдя (TS). При р = const і Т = const загальну рушійну силу процесу, що позначають ΔG, можна знайти зі співвідношення
DG=(H2-H1)-(TS2-TS1), DG=ΔH-TΔS.
Величина G називається ізобарно-ізотермічним потенціалом або енергією Гіббса. Отже, мірою хімічної спорідненості є зменшення енергії Гіббса (DG), що залежить від природи речовини, її кількості і від температури. Енергія Гіббса є функцією стану, тому
 (3)
(3)
Мимовільно протікаючі процеси йдуть у бік зменшення енергії Гіббса, у бік зменшення DG. Якщо DG < 0, процес принципово здійсненний; якщо DG >0, процес мимовільно проходити не може. Чим менше DG, тим сильніше прагнення до протікання даного процесу і тим далі він від стану рівноваги, при якому DG = 0 і DН= TDS.
Зі співвідношення DG = DН — TDS видно, що самочинно можуть протікати і процеси, для яких DН > 0 (ендотермічні). Це можливо, коли DS > 0, але |ТDS| > |DН|, і тоді DG < 0. З іншого боку, екзотермічні реакції (DН < 0) самочинно не протікають, якщо при DS < 0 виявиться DG > 0.
Таблиця 6 – Стандартна енергія Гіббса утворення DG  деяких речовин
деяких речовин
| Речовина | Стан | DG  , кДж/моль , кДж/моль
| Речовина | Стан | DG  , кДж/моль , кДж/моль
|
| ВаСО3 СаСО3 Fe3 О4 ВеСО3 СаО ВеО ВаО СО2 NaCІ ZnO | к к к к к к к г к к | -1138,8 -1128,75 -1014,2 -944,75 -604,2 -581,61 -528,4 -394,38 -384,03 -318,2 | FeО Н2О Н2О РвО2 СО СН4 NO2 NO С2Н2 | к р г к г г г г г | -244,3 -237,19 -228,59 -219,0 137,27 -50,79 +51,84 +86,69 +209,20 |
Приклад 1. У якому стані ентропія 1 моль речовини більше: у кристалічному чи в пароподібному при тій же температурі?
Розв’язання. Ентропія є мірою невпорядкованості стану речовини. У кристалі частки (атоми, іони) розташовані упорядковано і можуть знаходитися лише у визначених точках простору, а для газу таких обмежень немає. Об’єм 1 моль газу набагато більше, ніж об’єм 1 моль кристалічної речовини; можливість хаотичного руху молекул газу більше. Так як ентропію можна розглядати як кількісну міру хаотичності атомно-молекулярної структури речовини, то ентропія 1моль пари речовини більше ентропії 1 моль її кристалів за однаковою температурою.
Приклад 2. Пряма чи зворотна реакція буде протікати за стандартних умов у системі
СН4(г) + СО2(г) 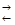 2СО(г) + 2Н2(г)?
2СО(г) + 2Н2(г)?
Розв’язання. Для відповіді на питання варто обчислити DG  прямої реакції. Значення ΔG
прямої реакції. Значення ΔG  відповідних речовин наведені в таблиці 6. Оскільки DG є функцією стану і DG для простих речовин, що знаходяться в стійких при стандартних умовах агрегатних станах, дорівнюють нулю, знаходимо DG
відповідних речовин наведені в таблиці 6. Оскільки DG є функцією стану і DG для простих речовин, що знаходяться в стійких при стандартних умовах агрегатних станах, дорівнюють нулю, знаходимо DG  процесу:
процесу:
ΔG  = 2·(-137,27)+ 2·(0)-(-50,79-394,38)=+ 170,63 кДж.
= 2·(-137,27)+ 2·(0)-(-50,79-394,38)=+ 170,63 кДж.
Те, що DGo298> 0, говорить про неможливість самочинного протікання прямої реакції при Т =298 К і однакових тисках узятих газів 1,013 105Па.
Приклад 3. На підставі стандартних теплот утворення (таблиця 5) і абсолютних стандартних ентропій речовин (таблиця 7) обчислити DG  реакції, що протікає за рівнянням
реакції, що протікає за рівнянням
СО(г) + Н2О(р) =СО2(г) + Н2(г).
Розв’язання. DG0 =DН - TDS; DН і DS — функції стану, тому
DН 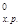 = (- 393,51 +0) - (-110,52 - 285,84) =+2,85 кДж,
= (- 393,51 +0) - (-110,52 - 285,84) =+2,85 кДж,
DS 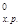 = (213,65 + 130,59) - (-197,91 + 69,94) = +76,39 Дж/мольК=
= (213,65 + 130,59) - (-197,91 + 69,94) = +76,39 Дж/мольК=
= 0,07639 кДж/(моль·К),
G 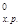 = +2,85 - 298 · 0,07639 = - 19,91кДж.
= +2,85 - 298 · 0,07639 = - 19,91кДж.
Таблиця 7 – Стандартні абсолютні ентропії S  деяких речовин
деяких речовин
| Речовина | Стан | S  , Дж/(моль·К) , Дж/(моль·К)
| Речовина | Стан | S  , Дж/(моль·К) , Дж/(моль·К)
|
| С | Алмаз | 2,44 | Н20 | г | 188,72 |
| С | Графіт | 5,69 | N2 | г | 191,49 |
| Fe | к | 27,2 | NH3 | г | 192,50 |
| Ti | к | 30,7 | СО | г | 197,91 |
| S | Ромб. | 31,9 | С2Н2 | г | 200,82 |
| TiО2 | к | 50,3 | О2 | г | 205,03 |
| FeO | к | 54,0 | H2S | г | 205,64 |
| H2O | р | 69,94 | NО | г | 210,20 |
| Fe2О3 | к | 89,96 | СО2 | г | 213,65 |
| NH4CI | к | 94,5 | С2Н4 | г | 219,45 |
| CH3OH | р | 126,8 | CI2 | г | 222,95 |
| H2 | г | 130,59 | NO2 | г | 240,46 |
| Fe3O4 | к | 146,4 | PCI3 | г | 311,66 |
| CH4 | г | 186,19 | РСІ5 | г | 352,71 |
| HCI | г | 186,68 |
Приклад 4. Реакція відновлення Fe2O3 воднем протікає за рівнянням
Fe2O3(к) + 3Н2(г)=2Fe(к) + ЗН2О(г); ΔН = +96,61 кДж.
Чи можлива ця реакція при стандартних умовах, якщо зміна ентропії ΔS = 0,1387 кДж/(моль·К)? При якій температурі почнеться відновлення Fe2O3?
Розв’язання. Обчислюємо ΔG реакції:
ΔG = ΔН - ТΔS = 96,61 - 298·0,1387 =+55,28 кДж.
Оскільки DG > 0, то реакція при стандартних умовах неможлива; навпаки, при цих умовах йде зворотна реакція окислювання заліза (корозія). Знайдемо температуру, при якій ΔG = 0:
ΔН = ТΔS; Т=  .
.
Отже, при температурі» 696,5К почнеться реакція відновлення Fe2O3. Іноді цю температуру називають температурою початку реакції.
Приклад 5. Обчислити ΔН0, ΔS0 і ΔG 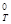 реакції, що протікає за рівнянням
реакції, що протікає за рівнянням
Fe2O3(к) + ЗС =2Fe + 3СО.
Чи можлива реакція відновлення Fe2O3 вуглецем при температурах 500 і 1000 К?
Розв’язання. ΔН 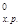 і ΔS
і ΔS 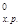 знаходимо із співвідношень (1) і (2) так само, як у прикладі 3:
знаходимо із співвідношень (1) і (2) так само, як у прикладі 3:
ΔН 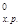 = [3 (-110,52) + 2·0] - [-822,10 + 3·0] = -331,56 + 822,10 = +490,54 кДж,
= [3 (-110,52) + 2·0] - [-822,10 + 3·0] = -331,56 + 822,10 = +490,54 кДж,
ΔS 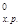 = (2·27,2 + 3·197,91) - (89,96 + 3·5,69) = 541,1 Дж/К.
= (2·27,2 + 3·197,91) - (89,96 + 3·5,69) = 541,1 Дж/К.
Енергію Гіббса при відповідних температурах знаходимо зі співвідношення
ΔG 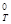 = ΔН
= ΔН  - ТΔS:
- ТΔS:
ΔG 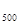 = 490,54-500
= 490,54-500 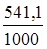 = + 219,99 кДж,
= + 219,99 кДж,
ΔG  =490,54- 1000
=490,54- 1000 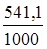 = - 50,56 кДж.
= - 50,56 кДж.
Оскільки ΔG 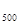 > 0, а ΔG
> 0, а ΔG  < 0, то відновлення Fe2O3 вуглецем можливо при 1000 К та неможливо при 500 К.
< 0, то відновлення Fe2O3 вуглецем можливо при 1000 К та неможливо при 500 К.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1379; Нарушение авторских прав?; Мы поможем в написании вашей работы!