
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способи вираження концентрації розчину
|
|
|
|
Концентрацією розчину називається кількість розчиненої речовини, що міститься у визначеній масі чи у відомому об'ємі розчину або розчинника.
Приклад 1. Обчислити: а) масову частку (С%); б) молярну (СМ);
в) нормальну (СН); г) моляльну (См) концентрації розчину Н3РО4, отриманого при розчиненні 18 г кислоти в 282 см3 води, якщо густина його 1,031г/см3. Чому дорівнює титр (Т) цього розчину?
Розв’язання: а) масова частка показує число грамів (одиниць маси) речовини, що міститься в 100 г (одиниць маси) розчину. Так як масу 282 см3 води можна прийняти рівною 282 г, то маса отриманого розчину 18+282 = =300 г і, звідки:
300 – 18,
100 - С%,
С% = 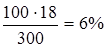 ;
;
б) мольно-об’ємна концентрація, тобто молярність, показує число молів розчиненої речовини, що містяться в 1 л розчину. Маса 1 л розчину 1031 г/см3. Масу кислоти в літрі розчину знаходимо зі співвідношення
300 – 18,
1031 – х,
х = 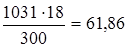 .
.
Молярність розчину одержимо діленням числа грамів НЗРО4 у 1 л розчину на мольну масу НЗРО4 (97,99 г/моль) СМ = 61,86/97,99 = 0,63 м;
в) еквівалентна концентрація, чи нормальність, показує число еквівалентів розчиненої речовини, що містяться в 1 л розчину.
Так як еквівалентна маса Н3РО4= М/3 =97,99/3 = = 32,66 г/моль, то
Сн = 61,86/32,66= 1,89 н.;
г) мольно-масова концентрація, тобто моляльність, показує, яке число моль розчиненої речовини міститься в 1000 г розчинника. Масу Н3РО4 у 1000 г розчинника знаходимо із співвідношення:
282 — 18,
1000 — х,
х = 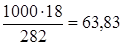 .
.
Звідки См=63,83/97,99=0,65 м.
Титром розчину називається кількість грамів розчиненої речовини в 1см3 (мл) розчину. Так як в 1 л розчину міститься 61,86 г кислоти, то
Т= 61,86/1000 = 0,06186 г/см3.
Знаючи нормальність розчину й еквівалентну масу (mе) розчиненої речовини, титр легко знайти за формулою T=CН·mе /1000.
Приклад 2. На нейтралізацію 50 см3 розчину кислоти витрачено 25см3 0,5н. розчину лугу. Чому дорівнює нормальність кислоти?
Розв’язання. Так як речовини взаємодіють між собою в еквівалентних співвідношеннях, то розчини рівної нормальності peaгують у рівних об’ємах. Якщо нормальності відрізняються, об’єми розчинів речовин, що реагують, зворотно пропорційні їх нормальностям, тобто
V1/V2 = СН2/СН1, або V1·СН1 = V2·СН2,
50·СН1 = 25·0,5, відкіля СН1 = 25·0,5/50 = 0,25 н.
Приклад 3. До 1 л 10%-ного розчину КОН (густина 1,092 г/см3) додали 0,5 л 5%-ного розчину KОH - (густина 1,045 г/см3). Об'єм суміші довели до 2 л. Обчислити молярну концентрацію отриманого розчину.
Розв’язання. Маса одного літра 10%-ного розчину КОН 1092 г. У цьому розчині міститься 1092·10/100=109,2 г КОН.
Маса 0,5 л 5%-ного розчину 1045·0,5=522,5 г. У цьому розчині міститься 522,5·5/100 = 26,125 г КОН.
У загальному об’ємі отриманого розчину (2 л) маса КОН складає: 109,2+26,125=135,325 г. Звідси молярність цього розчину
СМ=135,325/2·56,1 = 1,2 М, де 56,1 г/моль — мольна маса КОН.
Приклад 4. Який об’єм 96%-ної сульфатної кислоти, густина якої 1,84 г/см3, буде потрібно для приготування 3 л 0,4 н розчину?
Розв’язання. Еквівалентна маса Н2SО4=М/2 = 98,08/2=49,04 г/моль. Для приготування 3 л 0,4 н. розчину потрібно 49,04·0,4·3 =58,848 г H2SO4. Маса 1см3 96%-ної кислоти 1,84 г. У цьому розчині міститься
1,84·96/100 = 1,766г H2SO4.
Отже, для готування 3 л 0,4 н. розчину треба узяти 58,848:1,766 = =33,32см3 цієї кислоти.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 763; Нарушение авторских прав?; Мы поможем в написании вашей работы!