
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гідроліз солей
|
|
|
|
Хімічна обмінна взаємодія між іонами розчиненої солі та води, яка приведе до утворення малодисоційованих продуктів (молекул слабких кислот чи основ аніонів кислих або катіонів основних солей) і супроводжується зміненням рН середовища, має назву гідролізу.
Приклад 1. Скласти іонно-молекулярні та молекулярні рівняння гідролізу солей: а) КСN, б) Na2CO3, в)ZnSO4. Визначити реакцію середовища розчинів цих солей.
Розв’язання. а) Ціанід калію KCN — сіль слабкої одноосновної кислоти (див. таблицю 9) HCN і сильної основи КОН. При розчиненні у воді молекули KCN цілком дисоціюють на катіони К+ і аніони CN  . Катіони К+ не можуть зв'язувати іони ОН
. Катіони К+ не можуть зв'язувати іони ОН  води, тому що КОН - сильний електроліт. Аніони ж CN
води, тому що КОН - сильний електроліт. Аніони ж CN  зв'язують іони Н+ води, утворивши молекули слабкого електроліту HCN. Сіль гідролізується, як говорять, по аніону. Іонно-молекулярне рівняння гідролізу
зв'язують іони Н+ води, утворивши молекули слабкого електроліту HCN. Сіль гідролізується, як говорять, по аніону. Іонно-молекулярне рівняння гідролізу
СN  + H2O = HCN + OH
+ H2O = HCN + OH 
чи в молекулярній формі
KCN + Н2O = HCN + КOН.
В процесі гідролізу в розчині з'являється деякий надлишок іонів ОН  тому розчин KCN має лужну реакцію (рн > 7);
тому розчин KCN має лужну реакцію (рн > 7);
б) карбонат натрію Na2CO3-сіль слабкої многоосновної кислоти і сильної основи. У цьому випадку аніони солі СО3 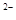 , зв'язуючи водневі іони води, утворюють аніони кислої солі НСО3
, зв'язуючи водневі іони води, утворюють аніони кислої солі НСО3  , а не молекули Н2СО3, тому що іони НСО3
, а не молекули Н2СО3, тому що іони НСО3  дисоціюють набагато важче, ніж молекули Н2СО3. У звичайних умовах гідроліз йде за першим ступенем. Сіль гідролізується за аніоном. Іонно-молекулярне рівняння гідролізу
дисоціюють набагато важче, ніж молекули Н2СО3. У звичайних умовах гідроліз йде за першим ступенем. Сіль гідролізується за аніоном. Іонно-молекулярне рівняння гідролізу
СО3 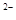 + Н2О = НСО3
+ Н2О = НСО3  + ОН
+ ОН 
чи в молекулярній формі
Na2CO3 + H2O= NaHCO3 + NaOH.
У розчині з'являється надлишок іонів ОН  , тому розчин Na2CO3 має лужну реакцію (рH > 7);
, тому розчин Na2CO3 має лужну реакцію (рH > 7);
в) сульфат цинку ZnSO4- сіль слабкої багатокислотної основи Zn(OH)2 та сильної кислоти H2SO4. У цьому випадку катіони Zn2+ зв'язують гідроксильні іони води, утворюючи катіони основної солі ZnOH+. Утворення молекул Zn(OH)2 не відбувається, тому що іони ZnOH+ дисоціюють набагато важче, ніж молекули Zn(OH)2. У звичайних умовах гідроліз перебігає за першим ступенем. Сіль гідролізується по катіону. Іонно-молекулярне рівняння гідролізу
Zn2+ + Н2О =ZnOH++ Н+
або в молекулярній формі
2ZnSO4 + 2Н2O = (ZnOH)2S04 + H2SO4.
У розчині утворюється надлишок іонів водню, тому розчин ZnSO4 має кислу реакцію (рН < 7).
Приклад 2. Які продукти утворюються за змішуванням розчинів А l (NO3)3 та К2СО3? Складіть іонно-молекулярне й молекулярне рівняння реакції.
Розв’язання. Гідроліз солі А l (NO3)3 відбувається за катіоном, а К2СО3 – за аніоном:
А l 3+ + H2O = A l OH2+ + H+,
CO3 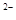 + H2O = HCO3
+ H2O = HCO3  + OH
+ OH  .
.
Якщо розчини цих солей знаходяться в одній судині, то відбувається взаємне посилення гідролізу кожної з них, тому що іони Н+ і ОН- утворюють молекулу слабкого електроліту Н2О. При цьому гідролітична рівновага зміщується вправо та гідроліз кожної з цих солей відбувається до кінця з утворенням А1(ОН)3 та СО2 (Н2СО3). Іонно-молекулярне рівняння:
2А l 3+ + 3CO3 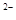 + 3 H2O = 2A l (OH)3 + 3 CO2.
+ 3 H2O = 2A l (OH)3 + 3 CO2.
Молекулярне рівняння
2AI(NO3) 3 + 3К2СО3 + 3Н2О =2А l (ОН)3 + 3СО2 + 6KNO3.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1262; Нарушение авторских прав?; Мы поможем в написании вашей работы!