
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Електродні потенціали та електрорушійні сили
|
|
|
|
При розв’язанні задач цього розділу див. таблицю 8.
Якщо металеву пластинку опустити у воду, то катіони металу на її поверхні гідратуються полярними молекулами води і переходять у рідину. При цьому електрони, які у надлишку залишаються в металі, заряджають його поверхневий шар негативно. Виникає електростатичне притягування між гідратованими катіонами, які перейшли в рідину та поверхню металу. У результаті цього в системі встановлюється рухлива рівновага:
Ме +mH2O = Me(H2O)mn+ + n 
у розчині на металі,
де n — число електронів, що беруть участь у процесі. На межі метал — рідина виникає подвійний електричний шар, що характеризується визначеним стрибком потенціалу — електродним потенціалом. Абсолютні значення електродних потенціалів вимірити не вдається. Електродні потенціали залежать від ряду факторів (природи металу, концентрації, температури та ін.). Тому звичайно визначають відносні електродні потенціали у визначених умовах – так звані стандартні електродні потенціали (Е°).
Стандартним електродним потенціалом металу називають його електродний потенціал, що виникає при зануренні металу в розчин власного іона з концентрацією (чи активністю), рівною 1 моль/л, обмірюваний у порівнянні зі стандартним водневим електродом, потенціал якого при 250С умовно приймається рівним нулю (Е° = 0; DG° = 0).
Розташовуючи метали в ряд у міру зростання їх стандартних електродних потенціалів (Е°), одержуємо так званий ряд напруг.
Положення того чи іншого металу в ряді напруг характеризує його відновну здатність, а також окисні властивості його іонів у водяних розчинах при стандартних умовах. Чим менше значення E°, тим більшими відновними властивостями володіє даний метал у вигляді простої речовини і тим менші окисні властивості виявляють його іони, і навпаки. Електродні потенціали вимірюють у приладах, що одержали назву гальванічних елементів. Окисно-відновна реакція, що характеризує роботу гальванічного елемента, протікає в напрямку, у якому ЕРС елемента має позитивне значення. У цьому випадку DG° < 0, тому що DG° =-nFE°.
Приклад 1. Стандартний електродний потенціал нікелю більше, ніж кобальту (таблиця 8). Чи зміниться це співвідношення, якщо вимірити потенціал нікелю в розчині його іонів з концентрацією 0,001 моль/л, а потенціали кобальту — у розчині з концентрацією 0,1 моль/л?
Таблиця 8 – Стандартні електродні потенціали (Е °) деяких металів (ряд напруг)
| Електрод | Е0, В | Електрод | Е°,B |
| L i+/ L i | -3,045 | Cd2+/Cd | -0,403 |
| Rb+/Rb | -2,925 | Со2+/Со | -0,277 |
| K+/K | -2,924 | Ni2+/Ni | -0,25 |
| Cs+/Cs | -2,923 | Sn 2+/Sn | -0,136 |
| Ba2+/Ba | -2,90 | РЬ2+/РЬ | -0,127 |
| Ca2+/Ca | -2,87 | Fe3+/Fe | -0,037 |
| Na+/Na | -2,714 | 2Н+/Н2 | -0,000 |
| Mg2+/Mg | -2,37 | Sb3+/Sb | + 0,20 |
| A l 3+/A l | -1,70 | Bi3+/Bi | +0,215 |
| Ti2+/Ti | -1,603 | Cu2+/Cu | +0,34 |
| Zr4+/Zr | -1,58 | Cu+/Cu | +0,52 |
| Mп2+/Мп | -1,18 | Hg22++/2Hg | +0,79 |
| V2+/V | -1,18 | Ag+/Ag | +0,80 |
| Сr2+/Cr | -0,913 | Hg2+/Hg | +0,85 |
| Zn2+/Zn | -0,763 | Pt 2+/Pt | +1,19 |
| Cr3+/Cr | -0,74 | Au3+/Au | +1,50 |
| Fe2+/Fe | -0,44 | Au+/Au | +1,70 |
Рішення. Електродний потенціал металу (Е) залежить від концентрації його іонів у розчині. Ця залежність виражається рівнянням Нернста:
 ,
,
де Е0– стандартний електродний потенціал; n – число електронів, що беруть участь у процесі; С – концентрація (при точних обчисленнях – активність) гідратованих іонів металу в розчині, моль/л; Е° для нікелю і кобальту відповідно рівні -0,25 та -0,277 В. Визначимо електродні потенціали цих металів при даних в умові концентраціях:


Таким чином, при концентрації, що змінилася, потенціал кобальту став більше потенціалу нікелю.
Приклад 2. Магнієву пластинку опустили в розчин його солі. При цьому електродний потенціал магнію дорівнює -2,41 В. Обчислити концентрацію іонів магнію (моль/л).
Розв’язання. Подібні задачі також розв’язуються на основі рівняння Нернста (див. приклад 1):
 ,
,
 ,
,
 ,
,

Приклад 3. Складіть схему гальванічного елемента, у якому електродами є магнієва і цинкова пластинки, опущені в розчини їхніх іонів з активною концентрацією 1 моль/л. Який метал є анодом, який катодом? Напишіть рівняння окисно-відновної реакції, що протікає в цьому гальванічному елементі, та обчисліть його ЕРС.
Розв’язання. Схема даного гальванічного елемента
-Мg/Mg2+//Zn2+/Zn (+).
Вертикальна лінійка позначає поверхню розділу між металом і розчином, а дві лінійки – границю розділу двох рідких фаз – пористу перегородку (чи сполучну трубку, заповнену розчином електроліту). Магній має менший потенціал (– 2,37 В) і є анодом, на якому протікає окисний процес:
 .
.
Цинк, потенціал якого - 0,763 В, — катод, тобто електрод, на якому протікає відновний процес:
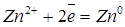 .
.
Рівняння окислювально-відновної реакції, що характеризує роботу даного гальванічного елемента, можна одержати, склавши електронні рівняння анодного (1) і катодного (2) процесів:
Mg + Zn2+=Mg2+ + Zn.
Для визначення ЕРС гальванічного елемента з потенціалу катода треба відняти потенціал анода. Тому що концентрація іонів у розчині дорівнює 1 моль/л, то ЕРС елемента дорівнює різниці стандартних потенціалів двох його електродів:

|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 2935; Нарушение авторских прав?; Мы поможем в написании вашей работы!