
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Електроліз
|
|
|
|
Приклад 1. Яка маса міді виділиться на катоді під час електролізу розчину CuSO 4 протягом 1 год при силі струму 4 А?
Розв’язання. Згідно з законом Фарадея
m = E·І·t /96500, (1)
де m – маса речовини, яка окислюється або відновлюється на електроді;
E – еквівалентна маса речовини;
І – сила струму, А;
t – час електролізу, c.
Еквівалентна маса міді СuSO4 дорівнює 63,54: 2 = 31, 77г/моль.
Звідки Е = 31,77, І =4А, t =60 60 =3600 c.
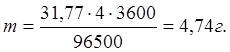
Приклад 2. Обчислити еквівалентну масу металу, знаючи, що при електролізі розчину хлориду цього металу витрачено 3880 Кл електрики і на катоді виділяється 11,742 г металу.
Розв’язання. З формули (1)
Е= 11,742 96500/3880 = 29,35 г/моль,
де m = 11,742 г, It = Q = 3880 Кл.
Приклад 3. Чому дорівнює сила струму під час електролізу розчину протягом 1 год 40 хв 25 с, якщо на катоді утворюється 1,4 л водню (н.у.)?
Розв’язання. З формули (1)
І =m 96500/Et.
Так як даний об’єм водню є відомим, то співвідношення m/E замінюємо співвідношенням 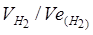 ,
,
де 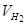 - об’єм водню, л;
- об’єм водню, л;
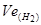 - еквівалентний об’єм водню, л.
- еквівалентний об’єм водню, л.
Звідки
 .
.
Еквівалентний об’єм водню при н.у. дорівнює половині молярного об’єму 22,4/2 =11,2 л. Записуємо в формулу значення 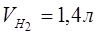 ,
,
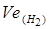 =11,2 л, t = 6025 (1год 40 хв 25с) = 6025 с
=11,2 л, t = 6025 (1год 40 хв 25с) = 6025 с
і знаходимо
І= 1,4 96500/11,2 6025 = 2А.
Приклад 4. Яка маса гідроксиду калію утворилася біля катода під час електролізу розчину K2SO4, якщо на аноді виділилося 11,2 л кисню (н.у.)?
Розв’язання. Еквівалентний об’єм кисню (н.у.) 22,4/4 = 5,6 л. Отже, 11,2 л містять дві еквівалентні маси кисню. Стільки ж еквівалентних мас КОН утворилося на катоді або 56,11 2 = 112,22 г (56,11 г/моль – мольна та еквівалентна маса КОН).
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 575; Нарушение авторских прав?; Мы поможем в написании вашей работы!