
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Твердість води і методи її усунення
|
|
|
|
Твердість води є сумою міліеквівалентів іонів Са2+та Мg2+, які містяться в 1 л води (мекв/л). Один міліеквівалент твердості відповідає вмісту 20,04 мг/л Са2+ або 12,16 мг/л Мg2+.
Приклад 1. Розрахувати твердість води, знаючи, що в 500 л її міститься 202,5 г Са(НС03)2.
Розв’язання. У 1 л води міститься 202,5: 500 = 0,405 г Са (НСО3) 2, тобто 0,405: 81 = 0,005 еквівалентних мас або 5 мекв/л [81 г/моль – еквівалентна маса Са (НСО3)2. Тобто, твердість води 5 мекв.
Приклад 2. Скільки грамів CaSO4 міститься в 1 м3 води, якщо твердість, обумовлена присутністю цієї солі, дорівнює 4 мекв?
Розв’язання. Мольна маса CaSO4 136,14 г/моль; еквівалентна маса дорівнює 136,14:2 = 68,07 г/моль. У 1 м3 води твердістю 4 мекв міститься 4 1000 = = 4000 мекв, тобто 4000-68,07 = 272 280мг СаSO4.
Приклад 3. Яку масу соди треба додати до 500 л води, щоб усунути її твердість, яка дорівнює 5 мекв?
Розв’язання. У 500 л води міститься 500 5 = 2500 мекв солей, які обумовлюють твердість води.
Для усунення твердості варто додати 2500 53 = 132 500 мг = =132,5 г соди (53 г/моль — еквівалентна маса Na2СО3).
Приклад 4. Обчисліть карбонатну твердість води, знаючи, що на титрування 100 см3 цієї води, яка містить гідрокарбонат кальцію, витрачено 6,25 см3 0,08 н. розчину HC l.
Розв’язання. Обчислюємо нормальність розчину гідрокарбонату кальцію. Позначивши число еквівалентів розчиненої речовини в 1 л розчину, тобто нормальність, як х, складаємо пропорцію:
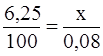 , х= 0,005 н.
, х= 0,005 н.
Таким чином, у 1 л води міститься 0,005 1000 = 5 мекв гідрокарбонату кальцію, тобто 5 мекв Са2+ іонів. Карбонатна твердість води 5 мекв.
Наведені приклади розв’язують, застосовуючи формулу
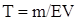 ,
,
де m — маса речовини, що обумовлює твердість води або використовується для усунення твердості води, мг; Е - еквівалентна маса цієї речовини; V- об’єм води, л.
Розв’язання прикладу 1. Тв =m/ЕV = 202500/81·500 = 5 мeкв. 81 - еквівалентна маса Са (НСО3)2, дорівнює половині його мольної маси.
Розв’язання прикладу 2. З формули Тв = m/ЕV, m = 4 68,07·1000 = =272280 мг = 272,280 г CaSO4.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1023; Нарушение авторских прав?; Мы поможем в написании вашей работы!