
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окисно-відновні реакції
|
|
|
|
КОНТРОЛЬНЕ ЗАВДАННЯ № 2
Окисно-відновними називаються реакції, що супроводжуються зміною ступеня окислювання атомів, що входять до складу речовин, що реагують. Під ступенем окислення (п) розуміють той умовний заряд атома, що обчислюється виходячи з припущення, що молекула складається тільки з іонів. Іншими словами: ступінь окислення — це той умовний заряд, що отримав би атом елемента, якщо припустити, що він прийняв або віддав те чи інше число електронів.
Відновна властивість елемента – це здатність віддавати електрони, окисна властивість – приєднувати їх. Окислення завжди супроводжується відновленням та навпаки. Відновники, віддаючи електрони, окислюються, а окисники, приєднуючи їх, відновлюються. Окисно-відновні реакції – це єдність двох протилежних процесів – окислення та відновлення. Окислення приводить до збільшення ступеню окислення відновника, а відновлення – до його пониження у окисника.
Один і той же елемент може виявляти різні властивості: окисні (у високих ступенях окислення), проміжні та відновні (у нижчих ступенях окислення).
Наприклад:
N5+ (HNO3) S6+(H2SO4) виявляють тільки окисні властивості,
 N4+ (NO2) S4+ (SO2)
N4+ (NO2) S4+ (SO2)
N3+ (HNO2) виявляють окисні та відновні
N2+ (NO) S2+ (SO) властивості,
N1+ (N2O)

 N0 (N2) S0 (S2, S8)
N0 (N2) S0 (S2, S8)
N  1 (NH2OH) S
1 (NH2OH) S  1(H2S2)
1(H2S2)
N  2 (N2H4)
2 (N2H4)
N  3 (NH3) S
3 (NH3) S  2(H2S) виявляють тільки відновні властивості.
2(H2S) виявляють тільки відновні властивості.
При окисно-відновних реакціях валентність атомів може і не змінюватися. Наприклад, в окисно-відновній реакції
Н20 + CI20 = =2H+С l  валентність атомів водню і хлору до і після реакції дорівнює одиниці. Змінився їхній ступень окислення. Валентність визначає число зв'язків, утворених даним атомом, і тому знака не має. Ступінь же окислення має знак як “плюс” так і “мінус”.
валентність атомів водню і хлору до і після реакції дорівнює одиниці. Змінився їхній ступень окислення. Валентність визначає число зв'язків, утворених даним атомом, і тому знака не має. Ступінь же окислення має знак як “плюс” так і “мінус”.
Приклад 1. Виходячи зі ступеня окислювання (п) азоту, сірки та марганцю в сполуках NH3, HNO2, HNO3, H2S, H2SO3, H2SO4, MnO2, KМnO4, визначити, які з них можуть бути тільки відновниками, тільки окислювачами та які виявляють як окисні, так і відновні властивості.
Розв’язання. Ступінь окислення п (N) у зазначених сполуках відповідно дорівнює: – 3 (нижчий), + 3 (проміжний), +5 (вищий); п (S) відповідно дорівнює: – 2 (нижчий), +4 (проміжний), +6 (вищий); п (Мn) відповідно дорівнює: +4 (проміжний), +7 (вищий). Звідки: NH3, H2S – тільки відновники; HNO3, H2SO4, КМnO4 – тільки окислювачі; HNO2, H2SO3, МnO2 – окислювачі і відновники.
Приклад 2. Чи можуть відбуватися окисно-відновні реакції між такими речовинами: a) H2S та HI; б) Н2S та H2SO3; в) H2SO3 та НСІО4?
Розв’язання. а) ступінь окислення в H2S п (S) = -2; у HI п (I) =-1. Тому що і сірка, і іод знаходяться у своєму нижчому ступені окислення, обидві узяті речовини виявляють тільки відновні властивості і взаємодіяти одна з одною не можуть; б) у H2S п (S) =- 2 (нижчий); у Н2SO3 n (S) =+4 (проміжний). Отже, взаємодії цих речовин можливі, причому H2SO3 є окислювачем; в) у H2SO3 п (S) =+4 (проміжний); у НCIO4 n (C l) = +7 (вищий). Узяті речовини можуть взаємодіяти. H2SO3 у цьому випадку буде виявляти відновні властивості.
Приклад 3. Складіть рівняння окисно-відновної реакції, що проходить за схемою
КМn+7О4 + Н3Р+3О3 + Н2SO4→ Мn+2SO4 + H3P+5O4 + K2SO4 + H2O.
Розв’язання. Якщо в умові задачі дані як початкові сполуки, так і продукти їхньої взаємодії, то написання рівняння реакції зводиться, як правило, до знаходження та розташування коефіцієнтів. Коефіцієнти визначають методом електронного балансу за допомогою електронних рівнянь. Обчислюємо, як змінюють свій ступінь окислення відновник та окислювач, і відображаємо це в електронних рівняннях:
 Відновник 5 Р3+-2
Відновник 5 Р3+-2  = Р5+ процес окислення;
= Р5+ процес окислення;
Окислювач 2 Мn7+ + 5  = Мn2+ процес відновлення.
= Мn2+ процес відновлення.
Загальна кількість електронів, відданих відновником, повинна дорівнювати кількості електронів, які приймає окислювач. Загальне найменше кратне для відданих і прийнятих електронів десять. Розділивши це число на 5, одержуємо коефіцієнт 2 для окислювача і продукту його відновлення, а при розподілі 10 на 2 одержуємо коефіцієнт 5 для відновника та продукту його окислення. Коефіцієнт перед речовинами, атоми яких не змінюють свій ступінь окислення, знаходять підбором. Рівняння реакції матиме вигляд
2КMnО4 + 5Н3РО3 + 3Н2SO4 = 2MnSO4 + 5H3PO4 + K2SO4 +3H2O.
Приклад 4. Складіть рівняння реакції взаємодії цинку з концентрованою сірчаною кислотою, з огляду на максимальне відновлення останньої.
Розв’язання. Цинк, як будь-який метал, виявляє тільки відновні властивості. У концентрованій сірчаній кислоті окисну функцію окислювача несе сірка (+6). Максимальне відновлення сірки вказує, що вона отримала мінімальний ступінь окислення. Мінімальний ступінь окислення сірки як р - елемента VIA групи дорівнює -2. Цинк як метал ІІВ групи має постійний ступінь окислення +2. Відображаємо сказане в електронних рівняннях:
 Відновник 4 Zn0 – 2
Відновник 4 Zn0 – 2  = Zn2+ процес окислення;
= Zn2+ процес окислення;
Окисник 1 S6+ + 8  = S
= S 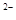 процес відновлення.
процес відновлення.
Складаємо рівняння реакції:
4Zn + 5H2SO4 =4ZnSO4+ H2S + 4H2O.
Перед H2SO4 стоїть коефіцієнт 5, а не 1, тому що чотири молекули H2SO4 ідуть на зв'язування чотирьох іонів Zn2+.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1243; Нарушение авторских прав?; Мы поможем в написании вашей работы!