
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Іонно-молекулярні (іонні) реакції обміну
|
|
|
|
При розв’язанні задач цього розділу див. таблицю А 1 додатка А та таблицю розчинності солей і основ у воді.
Іонно-молекулярні, чи просто іонні, рівняння реакцій обміну відбивають стан електроліту в розчині. Сильні розчинені електроліти, які цілком дисоційовані, записують у вигляді іонів, слабкі електроліти, малорозчинні і газоподібні речовини записують у молекулярній формі. В іонно-молекулярному рівнянні однакові іони з обох його частин виключаються. При складанні іонно-молекулярних рівнянь варто пам'ятати, що сума електричних зарядів у лівій частині рівняння повинна дорівнювати сумі електричних зарядів у правій частині рівняння.
Приклад 1. Написати іонно-молекулярні рівняння реакцій взаємодії між водними розчинами таких речовин: а) НC l і NaOH; б) Pb(NO3)2 і Na 2S; в) NaCIO і HNO3; г) К2СО3 і H 2SO4; д) СН3СООН і NaOH.
Розв’язання. Запишемо рівняння взаємодії зазначених речовин у молекулярному вигляді:
а) HC l + NaOH = NaCI + Н2O;
б) Pb (NO3)2 +Na 2S = PbS +2NaNO3;
в) NaCIO + HNO3 = NaNO3 + Нс l O;
г) К2СО3 + Н2SO4 = K2SO4 + CO2 + H2O;
д) СН3СООН + NaOH = CH3COONa + H2O.
Відзначимо, що взаємодія цих речовин можлива, тому що в результаті відбувається зв'язування іонів з утворенням слабких електролітів (Н2О, НС l O), осаду (PbS), газу (CO2).
У реакції (д) два слабких електроліти, але тому що реакції йдуть у бік більшого зв'язування іонів і вода - більш слабкий електроліт, ніж оцтова кислота, то рівновага реакції зміщена у бік утворення води. Виключивши однакові іони з обох частин рівняння a) Nа+ і С l -; б) Na+ і NO3-; в) Na+ і NO3-; г)К+ і SO42-; д) Na+, одержуємо іонно-молекулярні рівняння:
a) Н+ + ОН  - = Н2О;
- = Н2О;
б)Рb2+ + S 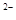 = PbS;
= PbS;
в) С l O  - + H+ = Hс l O;
- + H+ = Hс l O;
г) СО3 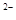 + 2Н+ = СО2 + Н2О;
+ 2Н+ = СО2 + Н2О;
д) СН3СООН + ОН  = СН3СОО
= СН3СОО  + Н2О.
+ Н2О.
Приклад 2. Скласти молекулярні рівняння реакцій, яким відповідають такі іонно-молекулярні рівняння:
а) SO3 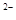 + 2H+ = SO2 + H2O;
+ 2H+ = SO2 + H2O;
б) Pb2+ + CrO4 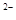 = PbCrO4;
= PbCrO4;
в) НСО3  + ОН
+ ОН  - = СО32- + Н2О;
- = СО32- + Н2О;
г) ZnOH+ + H+ = Zn2+ + H2O.
У лівій частині даних іонно-молекулярних рівнянь вказані вільні іони, що утворюються за дисоціацією розчинних сильних електролітів, отже, при складанні молекулярних рівнянь варто виходити з відповідних розчинних сильних електролітів. Наприклад:
а) Na 2S0 3+ 2НС1 = 2NaCI + S0 2 + Н2О;
б) Pb (NO3)2 + К2СrO4 = PbCr04 + 2KN03;
в) KHC03 + KOH = K 2CO 3+ H 2O;
r) ZnOHC l + НС l = ZnC l 2 + H2O.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 979; Нарушение авторских прав?; Мы поможем в написании вашей работы!