
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Контрольні питання. В умові задачі вказані вихідні концентрації, тоді як у вираз Кр входять тільки рівноважні концентрації усіх речовин системи
|
|
|
|
.
В умові задачі вказані вихідні концентрації, тоді як у вираз Кр входять тільки рівноважні концентрації усіх речовин системи. Припустимо, що до моменту рівноваги концентрації
[СО2]р = х моль/л. Відповідно до рівняння системи число молей водню, що утворився, при цьому буде також х моль/л. По стільки ж молей (х моль/л) СО і Н2О витрачається для утворення по х молей СО2 і Н2. Отже, рівноважні концентрації всіх чотирьох речовин
[СО2]р= [Н2]р = х моль/л; [СО]р= (3 - х) моль/л,
[Н2О]р= (2 - х)моль/л.
Знаючи константу рівноваги, знаходимо значення х, а потім рівноважні концентрації всіх речовин:
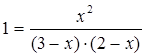 ,
,
х 2= 6 - 2 х - 3 х + х 2; 5 х =6, х = 1,2 моль/л.
Таким чином, рівноважні концентрації:
[СО2]р = 1,2 моль/л,
[H2]p = 1,2 моль/л,
[СО]р = 3 - 1,2 = 1,8 моль/л,
[H2O]p = 2 - 1,2=0,8 моль/л.
Приклад 4. Ендотермічна реакція розкладання пентахлориду фосфору протікає за рівнянням
РС l 5(г) 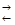 РС13(г) + C l 2(г),
РС13(г) + C l 2(г),  ΔН = + 92,59 кДж.
ΔН = + 92,59 кДж.
Як треба змінити: а) температуру; б) тиск; в) концентрацію, щоб змістити рівновагу у бік прямої реакції - розкладання PC l 5?
Розв’язання. Зміщенням чи зсувом хімічної рівноваги називають зміну рівноважних концентрацій речовин, що реагують, у результаті зміни однієї з умов реакції? Напрямок, у якому змістилася рівновага, визначається за принципом Ле-Шателье: а) так як реакція розкладання PC l 5 ендотермічна (ΔН > 0), то для зсуву рівноваги у бік прямої реакції потрібно підвищити температуру; б) тому що в даній системі розкладання PCI5 веде до збільшення об’єму (з однієї молекули газу утворяться дві газоподібні молекули), то для зсуву рівноваги убік прямої реакції треба зменшити тиск; в) зсуву рівноваги в зазначеному напрямку можна досягти як збільшенням концентрації РС l 5, так і зменшенням концентрації РС l 3 чи C l 2.
1 Окислення сірки і її діоксиду протікає за рівняннями:
a) S(к) + O2 = = S02(к);
б) 2S02(г) + 02=2S03(г).
Як зміняться швидкості цих реакцій, якщо об’єми кожної із систем зменшити в чотири рази?
2 Напишіть вираз для константи рівноваги гомогенної системи
Ν2 + 3Н2 «2ΝН3.
Як зміниться швидкість прямої реакції - утворення аміаку, якщо збільшити концентрацію водню в три рази?
3 Реакція йде за рівнянням N2 + О2 =2ΝО. Концентрації вихідних речовин до початку реакції були: [N2]=0,049 моль/л, [О2]=0,01 моль/л. Обчислити концентрацію цих речовин у момент, коли [NO]=0,005 моль/л.
Відповідь: [N2 ] = 0,0465 моль/л, [О2] = 0,0075 моль/л.
4 Реакція йде за рівнянням N2 + 3H2 =2NH3. Концентрації речовин, що беруть участь у ній, були: [N2] = 0,80 моль/л, [Н2] = 1,5моль/л,
[NH3] = 0,10 моль/л. Обчислити концентрацію водню й аміаку, коли [N2] = 0,5 моль/л.
Відповідь: [NH3]= = 0,70 моль/л, [Н2 ] = 0,60 моль/л.
5 Реакція йде за рівнянням Н2 + І2 =2НІ. Константа швидкості цієї реакції при деякій температурі дорівнює 0,16. Вихідні концентрації речовин, що реагують,: [Н2] = 0,04 моль/л, [І2] = 0,05 моль/л. Обчислити початкову швидкість реакції і її швидкість, коли [Н2 ]=0,03 моль/л.
Відповідь: 3,2·10-4, 1,9210-4.
6 Обчислити, у скільки разів зменшиться швидкість реакції, що протікає в газовій фазі, якщо понизити температуру від 120 до 800С. Температурний коефіцієнт швидкості реакції 3.
7 Як зміниться швидкість реакції, що протікає в газовій фазі, при підвищенні температури на 60 оС, якщо температурний коефіцієнт швидкості даної реакції 2?
8 В гомогенній системі С + С l 2 «СОС l 2 рівноважні концентрації речовин, що реагують: [СО] =0,2 моль/л, [С l 2] =0,3 моль/л, [СОС l 2] = =1,2 моль/л. Обчислити константу рівноваги системи і вихідні концентрації хлору і СО.
Відповідь: К = 20; [С l 2]вих. = 1,5 моль/л; [С]вих. = 1,4 моль/л.
9 Напишіть вираз для константи рівноваги гетерогенної системи СО2 + С«2СО. Як зміниться швидкість прямої реакції — утворення СО, якщо концентрацію СО2 зменшити в чотири рази? Як варто змінити тиск, щоб підвищити вихід СО?
10 Напишіть вираз для константи рівноваги гетерогенної системи С + Н2О(г) «СО+ Н2. Як треба змінити концентрацію й тиск, щоб зсунути рівновагу у бік зворотної реакції - утворення водяної пари?
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 897; Нарушение авторских прав?; Мы поможем в написании вашей работы!