
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічна кінетика і рівновага
|
|
|
|
Кінетика вивчає швидкість різних процесів, в тому числі хімічних реакцій. Критерієм принципової здійсненності реакцій є нерівність ΔG 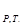 < 0. Але ця нерівність ще не є повною гарантією фактичного протікання процесу при даних умовах, не є достатньою для оцінки кінетичних можливостей реакції. Наприклад, DG
< 0. Але ця нерівність ще не є повною гарантією фактичного протікання процесу при даних умовах, не є достатньою для оцінки кінетичних можливостей реакції. Наприклад, DG 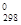 ,Н2О(г) = = -228,59 кДж/моль, а DG
,Н2О(г) = = -228,59 кДж/моль, а DG 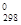 А l І 3(к)=-313,8кДж/моль, звідки, при Т=298 К і Р=1,03·105Па, можливі реакції
А l І 3(к)=-313,8кДж/моль, звідки, при Т=298 К і Р=1,03·105Па, можливі реакції
Н2(г) + 1/2О2(г) = Н2О(г),
2А l (к) + 3 І2(к) = 2А l І 3(к).
Але ці реакції при стандартних умовах йдуть тільки у присутності каталізатора (платини для першої і води для другої). Каталізатор нібито знімає кінетичне “гальмо”, і тоді виявляється термодинамічна природа речовини. Швидкість хімічних реакцій залежить від багатьох факторів, основні з яких – концентрація (тиск) реагентів, температура та дія каталізаторів. Ці фактори обумовлюють і досягнення рівноваги системі, що реагує.
Приклад 1. У скільки разів зміниться швидкість прямої та зворотної реакції системи
2SO2(г) + О2(г) = 2SO3(г),
якщо об’єм газової суміші зменшити в три рази? В який бік буде зміщуватись рівновага системи?
Розв’язання. Позначимо концентрації речовин, що реагують: [SO2]=а, [О2]= в, [SO3]=с. Згідно з законом діючих мас швидкість V прямої та зворотної реакції до зміни об’єму
Vпр.=к·а2· в; Vзвор.=к1·с2.
Після зменшення об’єму гомогенної системи в три рази концентрація кожної з речовин, що реагують, збільшилася в 3 рази: [SO2]=3а, [О2]=3 в, [SO3]=3с. При нових концентраціях швидкості V/ прямої і оборотної реакції:
V/пр.= к(3а2)(3 в) = 27к а2 в; V/звор.= к1(3с)2 = 9к1 с2.
Звідки
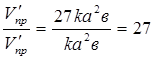 ;
; 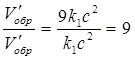 .
.
Отже, швидкість прямої реакції збільшилася в 27 разів, а зворотної - тільки в дев'ять разів. Рівновага системи змістилася у бік утворення SO3.
Приклад 2. Обчислити, у скільки разів збільшиться швидкість реакції, що протікає в газовій фазі, при підвищенні температури від 30 до 70оС, якщо температурний коефіцієнт реакції дорівнює 2.
Розв’язання. Залежність швидкості хімічної реакції від температури визначається емпіричним правилом Вант-Гоффа за формулою
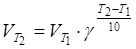 ,
,
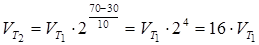 .
.
Отже, швидкість реакції 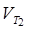 при температурі 70оС більше швидкості реакції
при температурі 70оС більше швидкості реакції 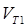 при температурі 30оС в 16 разів.
при температурі 30оС в 16 разів.
Приклад 3. Константа рівноваги гомогенної системи
СО(г) + Н2О(г) 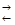 СО2(г) + Н2(г)
СО2(г) + Н2(г)
при 850°С дорівнює 1. Обчисліть концентрації всіх речовин при рівновазі, якщо вихідні концентрації: [СО]вих =3 моль/л, [Н2О]вих.=2моль/л.
Розв’язання. При рівновазі швидкості прямої і зворотної реакцій рівні, а співвідношення констант цих швидкостей постійне і називається константою рівноваги даної системи:
Vпр.= К1[СО][Н2О]; Vзвор.= К2[СО2][Н2],
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 656; Нарушение авторских прав?; Мы поможем в написании вашей работы!